RET基因是我们每个人都会携带的原癌基因,机体正常细胞的生长离不开它。但当RET基因发生致病性突变(点突变或融合突变)时,可引起细胞过度生长、增殖导致肿瘤发生。从这一角度看,RET是一个肿瘤驱动基因。RET基因激活突变与人类恶性肿瘤的发生是密切相关的——RET基因点突变常见于甲状腺髓样癌;而RET基因融合突变在肺癌、甲状腺癌、食管癌等常见肿瘤中都可出现。
本期小编将带大家回顾针对RET突变的靶向药,并重点介绍近期明星药物BLU-667。

目前针对RET基因的靶向药
1.凡德他尼、卡博替尼(XL184)和仑伐替尼(E7080):这三种药物虽针对RET,但属泛靶点靶向药,针对多个靶点而不够“专一”和“精准”,多靶点的抑制增加了其毒性,限制了临床应用。
2.BLU-667和LOXO-292:特定靶点靶向药,专门针对RET驱动基因突变,因作用“专一”和“精准”,因此临床疗效好,副反应小。近两年来BLU-667的研究结果令人激动,以下作详细介绍。

BLU-667前期研究数据
BLU-667是由BlueprintMedicines公司开发的一种高效且选择性的口服抑制剂,其靶向致癌RET-融合和抗性突变。临床前研究结果表明,在融合有KIF5B-RET的Ba/F3细胞中,BLU-667能抑制RET的自磷酸化,其效果比卡博替尼等要好10倍以上。
去年的AACR2018大会上,研究者首次公布了BLU-667的I期数据:该药对非小细胞肺癌(NSCLC)的客观缓解率(ORR)达50%,治疗时间最长的患者已经持续缓解11.4个月,仍在继续缓解;最小有效剂量为每天一次60mg,最大耐受剂量为每天一次400mg;最常见的1级副作用为便秘,3至4级副作用较少。这表明BLU-667在具有很好疗效和持续作用效果的同时,毒副反应低。

BLU-667最新研究结果
今年5月31日在美国芝加哥召开的ASCO年会上,BLU-667的疗效佳绩再次吸引了所有研究者的注意力,一起来看最新研究数据。
1、BLU-667用于NSCLC:
研究采用400mg QD起始剂量,入组120例初治或经治的RET融合NSCLC(其中KIF5B-RET型为66%,CCDC6-RET型为13%,其他类型占21%)。
1)ORR超过50%:
在可评价疗效的48例患者中,27例疗效达部分缓解(PR),1例达完全缓解(CR),ORR为58%;疾病控制率(DCR)为96%。对先前接受过含铂化疗的35例患者,1例达CR,20例达PR,DCR为100%(图1)。
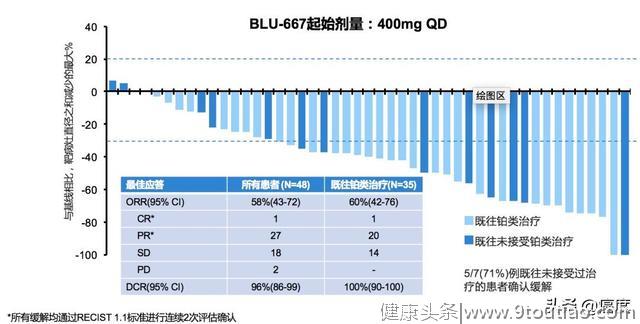
图1 BLU-667治疗RET融合突变晚期NSCLC具有很好的抗肿瘤活性
2)持续的肿瘤缓解时间:
28例达PR的患者中,19例(68%)患者的持续缓解时间超过6个月(图2)。
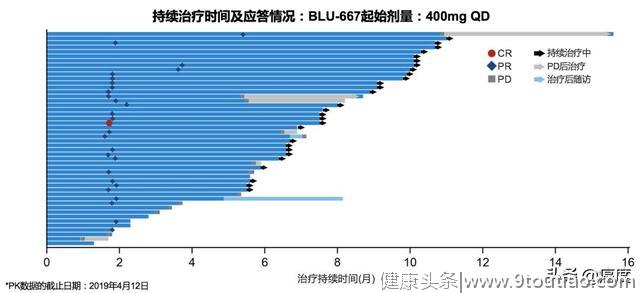
图2BLU-667治疗RET融合突变晚期NSCLC作用持续
3)是否接受免疫治疗、RET的融合类型、是否存在脑转移不影响疗效:
既往是否接受过接受抗PD-1/PD-L1治疗并不影响BLU-667的治疗疗效(图3A);RET融合类型与BLU-667的疗效关系也不大(图3B);此外,中枢神经(CNS)累及与否也不影响BLU-667的疗效(图3C)。表明BLU-667具有潜在广泛的应用群体。
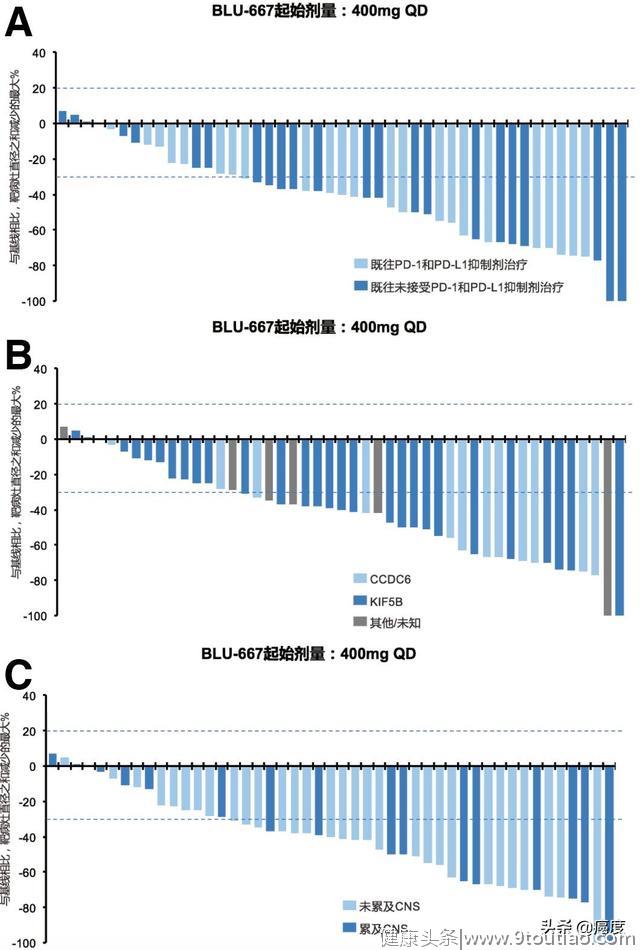
图3是否接受抗PD-1/PD-L1治疗(A)、RET的融合类型(B)、是否脑转移(C)不影响BLU-667疗效
4)安全性好:
400mg QD起始剂量下,BLU-667治疗相关毒性通常为低级别且可逆转。3级以上不良事件主要有中性粒细胞减少(13%)、高血压(13%)、贫血(7%)、AST升高(5%)。
2、BLU-667用于甲状腺癌:
研究入组64例RET突变的甲状腺髓样癌患者(36例M918T,10例C634R / S / W,3例V804M,15例其他突变)和5例RET融合的甲状腺癌乳头状癌患者(3例NCOA4-RET型,2例CCDC6-RET型)。其中,58%的患者先前有接受多激酶抑制剂治疗。
1)客观缓解率超过50%、作用持续、是否接受过多靶点RET抑制剂治疗不影响疗效:
在可评估疗效的32例甲状腺髓样癌患者中,1例达CR,17例达PR,ORR为56%;DCR达97%(图4)。其中,26例(81%)患者持续响应时间≥6个月;是否接受过多靶点RET抑制剂治疗不影响疗效。在可评估的6例甲状腺乳头状癌患者有5例疗效达PR,其中有5例继续治疗时间超一年。
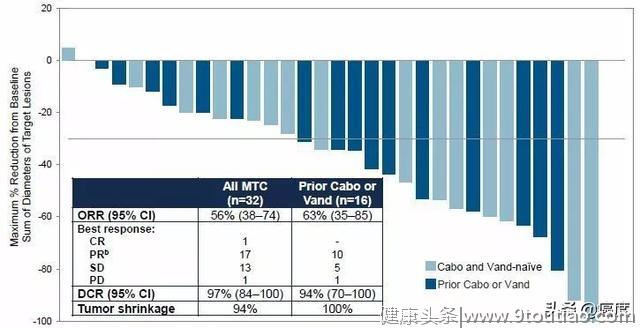
图4 BLU-667抗甲状腺癌的疗效
2)安全性好:
400mg QD起始剂量下治疗相关毒性小且可逆,无停药患者。3级以上不良事件主要包括高血压(15%)、中性粒细胞减少(7%)、低钙血症(4%)。
以上结果表明,针对RET驱动基因突变的NSCLC或甲状腺癌患者,BLU-667均表现出50%以上的ORR和90%以上的DCR,且肿瘤患者具有持续性、与RET突变类型无关;且耐受性好。这些临床研究数据均验证了RET的选择性靶向活性。

如何入组BLU-667临床研究
BLU-667具有极好的前期数据,但目前仍在临床试验阶段,还未上市。
那么如何加入BLU-667临床研究呢?
2018年,基石药业通过与Blueprint Medicines达成合作,获得了包括BLU-667在内的三种药物在国内的独家开发和商业化授权。2019年3月18日,中国国家药品监督管理局(NMPA)已批准RET抑制剂BLU-667在中国的I期临床试验,该试验作为国际ARROW研究的中国部分。ARROW研究是国际多中心临床试验,总共拟入组422人,其中中国90人。本试验的适应症是甲状腺髓样癌、含有RET 融合的NSCLC和其他含有RET变异的晚期实体肿瘤。国内研究中心设在天津市肿瘤医院,主要研究者是高明主任。目前试验已经开始招募患者,请RET病友多留意和询问。

小结
针对RET驱动基因突变的NSCLC或甲状腺癌患者,BLU-667表现出极佳的疗效和可耐受的不良事件。BLU-667的潜在应用人群是RET突变的NSCLC和甲状腺癌。NSCLC约有1%-2%的患者具有RET基因融合;在甲状腺髓样癌中有超过60%的患者存在RET基因突变,而在甲状腺乳头状癌中有10%的患者存在RET基因融合。目前,ARROW临床试验还在进行中,我们非常期待后续的研究结果,也期望这项临床试验能早日推动BLU-667上市,以造福更多人群。
"











