导读
膀胱尿路上皮癌(UBC)是全世界最常见的致死性癌症之一,卡介苗膀胱内免疫治疗是非肌层浸润性UBC的标准治疗方案。然而,过去的十年中,当代治疗方案并未明显改善患者的5年生存期。最新研究发现,部分局部晚期或转移性UBC患者对抗PD-1/PD-L1或CTLA-4检查点免疫治疗产生了反应,而在过去两年中,FDA批准了五种检查点抑制剂用于UBC治疗,这是晚期UBC治疗的巨大创新。
免疫系统分为固有免疫和适应性免疫,可以识别并摧毁恶性转化的细胞。宿主适应性免疫具有高度特异性、快速适应性以及长期记忆的特征。T细胞活化发生于特异性T细胞受体(TCR)与MHC呈递的抗原肽相互作用,CD28-B7共刺激增强MHC-抗原-TCR复合物的亲和力之后。T细胞被激活后,进行增殖和分化,并释放细胞因子,如干扰素γ(IFN-γ),攻击表达特定抗原的细胞。最新研究表明,内在负反馈信号转导可能控制T细胞过度反应,因此,T细胞活化也会诱导最终减弱并终止T细胞应答以维持免疫系统平衡的抑制通路。众所周知,检查点分子包括CTLA-4,PD-1/PD-L1。T细胞功能和免疫系统稳态取决于“开启”和“关闭”开关。
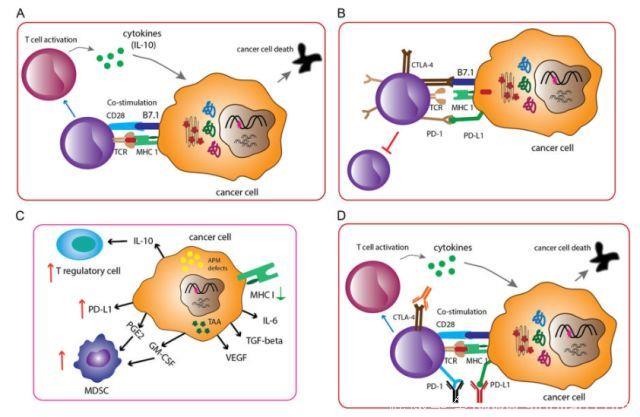
免疫监视是一种遗传机制,循环T细胞和B细胞可以通过这种机制将癌前细胞识别为“非我物质”,随后,免疫细胞攻击并破坏非正常细胞。免疫编辑通过注解三个阶段,详细描述了肿瘤细胞与免疫系统之间的动态相互作用:免疫清除、免疫平衡和免疫逃逸。活化T细胞成功抵抗肿瘤取决于肿瘤微环境的复杂性。肿瘤微环境是一种具有不同细胞类型的生态系统,它包含但不仅限于绝大多数肿瘤细胞,分散的基质细胞,抑制性细胞因子,调节性T细胞,髓源性抑制细胞,抗原,MHC分子表达以及肿瘤或免疫细胞表达PD-L1。因此,依据肿瘤浸润性淋巴细胞的数量和含量以及PD-L1蛋白的表达,TME划分为免疫原性“热”TME或非免疫原性“冷”TME。应用独特生物标志物监测“热”和“冷”TME可能是指导治疗的良好指标。
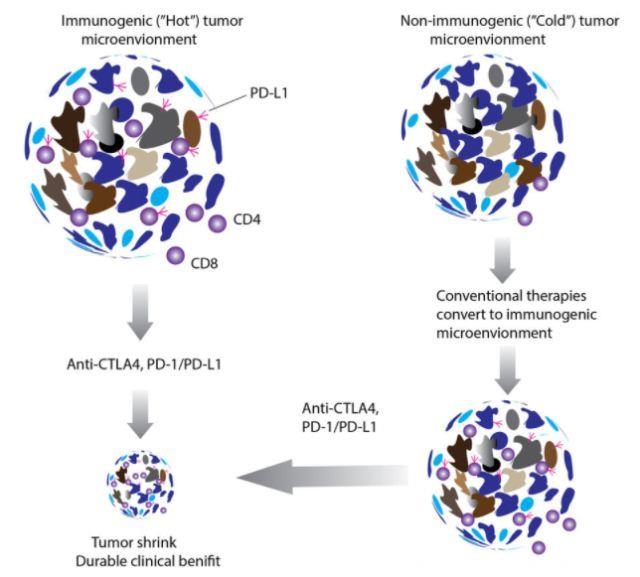
肿瘤免疫治疗包括注射特异性细胞因子,肿瘤相关抗原疫苗,输注过继性自体T细胞或基因工程T细胞,或者免疫检查点抑制剂。最新研究发现,肿瘤发生期间,体细胞突变产生的特异性新抗原可以诱导高度选择性T细胞应答,并且这些新抗原逐渐成为了极具吸引力的治疗靶标。治疗方案虽不同,但是它们均旨在增强免疫系统的活性,从而增强机体抵御癌症的天然防御机制。免疫检查点抑制剂开创了晚期膀胱癌治疗的新纪元。
尿路上皮膀胱癌的基因组特征
UBC是全世界最常见的泌尿道癌症之一。一般地,男性多于女性(比例3~4:1),复发率、转移率和死亡率很高。复发或转移性膀胱癌患者应用以顺铂为基础的化疗方案后中位生存时间为14-15个月,但是目前尚未发现可以延长总生存时间的有效二线治疗方案。最近,PD-L1抑制剂(atezolizumab, durvalumab, 和avelumab)和PD-1抑制剂(nivolumab和pembrolizumab)获FDA批准用于晚期或转移性UBC治疗。FDA批准的临床研究表明,整体客观缓解率(忽略PD-L1表达)为13%-24%,那么,问题来了:为什么某些患者对检查点抑制剂治疗有反应,而其他患者却没有呢?
早期研究表明,黑色素瘤和NSCLC的基因不稳定性与检查点抑制剂治疗反应有关。同样地,尿路上皮细胞基因组和表观基因组改变是UBC发病机制的驱动力。首先,UBC是具有最高突变负荷的癌症之一。体细胞平均突变率为7.7每兆碱基,仅次于黑色素瘤和NSCLC,逾30%的膀胱癌患者具有超过192个非同义突变。每个样本中平均有204个基因组拷贝数片段改变,302个非同义基因突变,以及22个基因组重排,UBC特异性已知基因CDKN1A (P21), EGCC2 (XPD),RXRA,ELF3(E74样ETS转录因子3),KLF5(转录因子),FOXQ1(叉头框蛋白Q1),RHOB(Rho相关GTP结合蛋白RhoB),PAIP1(多聚腺苷酸结合蛋白相互作用蛋白1)以及BTG(B细胞易位基因)以>3%的频率显著变异。
其次,多种染色质重塑基因,如KDM6A(赖氨酸脱甲基酶6A),CREBBP,EP300,和ARID1A(AT丰富结构域1A)在膀胱癌中高度突变。UBC肿瘤基因图谱计划(TCGA)研究发现,调控染色质重塑的基因在UBC中更频繁地发生突变。再次,染色体重排(如FGFR3–TACC3融合基因)和病毒整合(如HPV16)在UBC中周期性结构变异。以上基因组改变不仅改变了肿瘤细胞基本通路(p53/RB细胞周期通路,RTK/PI3K/mTOR增殖通路)特征以及UBC潜在药物靶标-组蛋白修饰染色质调控网络,也产生了许多可以被活化的效应T细胞识别的非我,或“外来”蛋白质。
此外,肿瘤体细胞突变产生的新抗原与抗PD-1或抗CTLA-4治疗反应正相关。PD-L1表达可能与更强的治疗反应相关,但是由于低PD-L1表达或无PD-L1表达的膀胱癌较传统化疗具有更强的反应疗效和更好的耐受性,因此PD-L1表达并非是最完美的生物标志物。最近,一项将atezolizumab作为顺铂不合格,局部转移性UBC患者一线临床治疗方案的II期试验证实,膀胱癌的基因组特征可能解释了免疫检查点抑制剂治疗带来的良好临床获益。
膀胱癌免疫治疗
免疫检查点抑制剂主要靶向肿瘤细胞或免疫细胞上表达的分子,这些分子作为“刹车”,会阻断T细胞的有效功能。检查点抑制剂治疗会释放“刹车”,进而促进预先存在的抗癌免疫反应。研究证实,CTLA-4, PD-1和PD-L1抑制剂在转移性黑色素瘤,晚期NSCLC,肾细胞癌以及晚期膀胱癌治疗中表现出显著的抗肿瘤反应。
非肌层浸润性膀胱癌(NMIBC)免疫治疗
NMIBC治疗的主要方式为肿瘤完全切除,然后诱导并维持膀胱内BCG疫苗免疫治疗或膀胱内灌注化疗。中至高危NMIBC患者BCG膀胱灌注治疗反应可达60%-70%,并具有长期治疗疗效。尽管高危NMIBC患者BCG免疫治疗取得了成功,但是〜30%的患者对治疗无反应。TME证据可能影响BCG治疗反应。BCG治疗失败的肿瘤具有少量效应细胞和较多抑制性免疫细胞,例如,肿瘤中CD4+亚群和GATA3+ T细胞很少;TME中FOXP3+,CD25+ Treg以及CD68+和CD163+肿瘤相关巨噬细胞表达很高。这种不断变化的复杂细胞生态学导致BCG治疗无应答。因此,BCG结合其他方法可能会改变TME和宿主免疫原性。一项研究表明,CTLA-4分子阻断剂联用标准BCG治疗可以增强患者的免疫活性,并改善NMIBC的临床结局。正在进行的检查点抑制剂和其他新型药物组合临床试验将为BCG难治性患者提供临床获益。

晚期和转移性膀胱癌免疫治疗
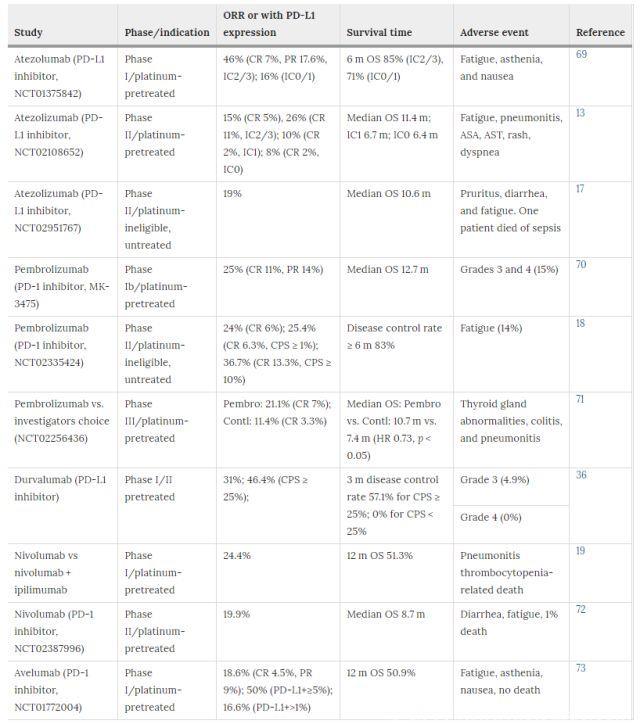
晚期或转移性膀胱癌患者的标准治疗包括顺铂为基础的化疗,然后手术切除膀胱,或放疗以及联合化疗。新修订的指南指出,对于未能从一线化疗获益的患者,免疫治疗将是一种重要的治疗方法。Atezolizumab是一种新研发的人抗PD-L1抗体,可以阻断PD-1受体与PD-L1结合,导致PD-1/PD-L1通路失活。Atezolizumab早期临床试验表明,晚期BCG患者常常在短时间内开始缓解,许多患者在6周内出现缓解,反应率为~48%。一项将PD-L1表达作为强大生物标志物来筛选受试者的I期研究结果表明,如果肿瘤浸润性免疫细胞表达PD-L1蛋白,那么肿瘤具有高反应率。另外,相较于细胞毒性化疗,检查点抑制剂治疗患者不良反应较少。因此,2016年5月atezolizumab获FDA批准用于晚期或转移性膀胱癌治疗。随后的II期临床研究(单臂和多中心)纳入了315例患者,结果表明,客观缓解率(14.8%)显著,临床反应持久。另一项试验表明,atezolizumab可作为未经治疗的转移性尿路上皮癌患者的初步一线治疗选择,客观缓解率为23%,这一发展正在改变UBC的治疗模式。
Durvalumab是另一种新兴PD-L1抑制剂。I期/ II期临床试验表明,durvalumab具有可控的安全性,PD-L1阳性转移性膀胱癌患者的客观缓解率为46.4%。基于这些结果,研究人员正在进行durvalumab单用或durvalumab+CTLA-4抑制剂,tremelimumab的多项临床试验。抗CTLA-4(ipilimumab和tremelimumab)或抗PD-1(pembrolizumab和nivolumab)单药治疗也处于不同阶段的临床试验中。2017年,FDA批准了四种检查点抑制剂,包括nivolumab(2017年2月2日),durvalumab, avelumab,和pembrolizumab(2017年5月),用于晚期膀胱癌二线或一线治疗。
肿瘤具有异质性,免疫治疗后出现动态缓解。TME中抑制性或刺激性分子表达较想象的更复杂。不同检查点抑制剂组合的多免疫治疗是一种必要的治疗方式,并且已经证实其在转移性黑色素瘤和晚期NSCLC中具有协同或累加疗效。因此,应用剂量优化、相继次序且安全性良好的多种检查点抑制剂治疗膀胱癌是合理的治疗选择。另外,传统治疗(化疗、放疗、手术或靶向治疗)结合免疫检查点治疗可能提高缓解率,使更多肿瘤患者获益。
免疫检查点抑制剂治疗的预测性生物标志物
免疫检查点抑制剂治疗已经在多种恶性肿瘤(如UBC)中表现出显著的临床疗效,持久缓解和低毒性。抗CTLA-4和抗PD-1抗体能够使部分晚期黑色素瘤患者获得长期疾病控制;靶向PD-1蛋白的抗体治疗在晚期NSCLC,黑色素瘤和肾细胞癌中的客观缓解率分别为18%, 28%, 和27%;早期试验表明,晚期膀胱癌抗PD-1治疗缓解率可达43.3%,后期大型队列研究表明,筛选的受试者缓解率>10%。然而,大多数检查点抑制剂治疗患者并未出现缓解,因此,为获得更好临床结果,通过生物标志物来分层或预测应答者至关重要。
CTLA-4在T细胞活化早期阶段发挥作用,而PD-1/PD-L1轴在晚期阶段起作用。2008年,一项临床试验纳入了12例早期UBC患者,并于根治性膀胱切除术前,对患者进行抗CTLA-4(ipilimumab)治疗,结果显示,诱导性共刺激因子(ICOS)表达在肿瘤组织和外周血液的CD4+T细胞亚群中显著增加。CD4+ICOShi T细胞亚群会释放更多有效的细胞因子,活化的免疫细胞可以识别肿瘤/睾丸抗原。此外,抗CTLA-4治疗与ICOS+CD4+T细胞亚群增加的相关性可以监测CTLA-4抑制剂的有效性。增强TME中效应因子和辅助T细胞功能或消耗Treg可能会增强CTLA-4抑制剂治疗的功效。
晚期黑色素瘤中,高体细胞突变负荷与CTLA-4抑制剂治疗长期临床获益相关,体细胞新表位负荷与CTLA-4抑制剂反应相关。如果患者具有更高的体细胞突变负荷,那么经atezolizumab治疗的转移性尿路上皮癌患者将获得更好的缓解。相较于无应答者,atezolizumab应答者的中位突变负荷显著增加。更严格讲,体细胞突变负荷与缓解之间的相关性与TCGA尿路上皮癌亚型或PD-L1表达亚组无关。膀胱癌的突变负荷是否可以作为检查点抑制剂治疗的独立预测参数仍需要大队列试验验证。突变表位与肿瘤内CTL浸润和记忆T细胞数量正相关。肿瘤周围高密度CD8+浸润与经atezolizumub治疗的晚期尿路上皮癌患者出现较好缓解相关,这表明免疫原性突变高负荷可能预测经检查点抑制剂治疗缓解的患者。然而,PD-L1表达,突变负荷与膀胱癌亚型组合可能能够说明转移性膀胱癌经检查点抑制剂治疗反应率的复杂性。
PD-1/PD-L1通路的作用机制不同于CTLA-4信号通路;TME中肿瘤细胞或免疫细胞表达PD-L1蛋白会抑制T细胞功能。因此,大多数研究将PD-L1蛋白作为生物标志物来筛选靶向PD-1/PD-L1通路抗体治疗的患者。一般而言,PD-L1表达越高,客观缓解率和生存率越好。抗PD-L1分子治疗转移性膀胱癌I期研究中,若预处理的肿瘤样本中PD-L1阳性肿瘤浸润细胞>5%,则PD-L1阳性肿瘤患者应用抗PD-L1单药治疗。在最少6周的随访中,相较于PD-L1阴性肿瘤患者(11.4%),PD-L1阳性肿瘤患者客观缓解率为43.3%。
尽管肿瘤组织中PD-L1蛋白表达与相对较高的缓解率相关,但是仍然存在悖论现象,即PD-L1治疗后,许多PD-L1阳性肿瘤确实无缓解,某些PD-L1阴性肿瘤却出现临床反应(肿瘤缩小或肿瘤稳定)。值得注意的是,nivolumab治疗,durvalumab治疗或pembrolizumab治疗的晚期尿路上皮癌患者的生存获益与PD-L1表达水平不一致。这些观察结果表明,仍需要其它生物标志物进行更精准,更精细的预测。
在基因水平上,错配修复缺陷NSCLC和结直肠癌体细胞总突变负荷与PD-1抑制剂治疗临床反应相关。某些研究表明,新抗原负荷或克隆新抗原负荷与抗PD-1反应显著相关。除了遗传基础之外,转录特征也是PD-1分子拮抗剂的潜在预测因子。
总结与展望
调节免疫细胞的抑制通路一直是肿瘤治疗的重大突破。大量研究已证实,应用人源化抗体靶向PD-1,PD-L1和CTLA-4蛋白的免疫检查点阻断疗法在部分晚期黑色素瘤,转移性NSCLC,转移性肾细胞癌和晚期膀胱癌患者中具有良好的临床反应,长期疾病控制和生存期改善。由于T细胞调节网络中存在许多其他的分子,研究人员正在积极研发新的拮抗剂来靶向其他抑制通路,如LAG-3,T细胞免疫球蛋白与黏蛋白结构域分子3,T细胞活化的V结构域免疫球蛋白抑制剂,和B淋巴细胞和T淋巴细胞抑制剂,以及促进刺激通路的激动剂(如ICOS,CD134和CD137)。
值得注意的是,新的有说服力的证据表明,免疫原性新抗原和细胞毒性T细胞识别新抗原是临床免疫反应的代表。个体化新抗原疫苗和免疫检查点抑制剂组合可能在多种实体瘤中取得更好的临床获益。另一方面,癌细胞可以逃避免疫监视,在选择性压力下,富含肿瘤浸润性淋巴细胞的肿瘤中可检测到高水平HLA基因突变,以及抗原-呈递-机制基因中的其他突变。因此,整体而言,研发用于精准膀胱癌免疫治疗、且具有完全预测性和预后性的生物标志物仍然面临挑战。
文章编译自:Wen Cheng, Dian Fu, Feng Xu & Zhengyu Zhang.Unwrapping the genomic characteristics of urothelial bladder cancer and successes with immune checkpoint blockade therapy.10.1038/s41389-017-0013-7.January 2018.
1.【肿瘤免疫学院IO秒懂系列21】且看CSF1R如何偷天换日
2. 组织依赖性TME与免疫治疗丨研究“拐点”
3.《Nature》重磅 | 免疫疗法最准确的生物标志物找到了?












