每一款疗法在获批上市的时候一定是因为“有确切疗效且疗效收益大于副作用”,的确,没有什么疗法是完美无缺的,都会有潜在的副作用,即使是最基础的外科手术。
癌症领域更不例外,不管是用了一个世纪之久的化疗,还是刚刚获批不到一年的 CAR-T,可是手术切除肿瘤能有什么副作用呢?实际上,转移性复发就一直被认为是手术的副作用,但争议也不是不存在的,支持者认为是手术使得癌细胞进入血液循环,导致了即使肿瘤全部切除也仍然会在其他部位复发。而反对者则认为,这本就是癌症的正常进展,可能在手术前就已经有少量癌细胞转移了,并不是手术的问题。
这个问题一直没有一个明确的答案,在最新的《科学转化医学》杂志上,美国怀特海德生物医学研究所 Robert A. Weinberg 教授的团队给出了新想法和证据。他们利用乳腺癌小鼠模型发现,不是手术本身,而是手术带来的伤口在愈合过程中诱导炎症反应,从而促进了肿瘤的转移性复发 [1]。

Robert A. Weinberg 教授
Weinberg 教授目前也在 MIT 任教职,他是怀特海德研究所的创始人之一,是癌症研究领域的先驱,以发现了人类第一个癌基因 Ras 和第一个肿瘤抑制基因 Rb 而“留名”[2]。
对于很多医生来说,告知患者“癌症复发了”甚至比告知患者诊断为癌症要困难和沉重得多,即使是乳腺癌这种临床预后比较理想的癌症,而一旦复发,治疗难度将成倍增加,大多数乳腺癌患者都是死于复发。
早在十年前就有研究人员发现,那些在早期被检查出来的,只观察到局部肿瘤的乳腺癌患者其实癌细胞早就已经悄悄扩散到远处了 [3]。不过数量少,也没有肿瘤微环境的支持,不成气候,只能悄悄的蛰伏,勉强可以算是“无害”[4]。关于这点还有一些更“极端”的发现,比如其实在原发肿瘤尚未成型前,癌细胞就已经进行了超早期转移了[5,6],今年年初还有研究为此提供了证据,同样是在乳腺癌小鼠中,研究人员表明这种现象是由巨噬细胞一手策划的[7]。
也就是说,沉睡的种子早就被埋下了,如果解决不了这个,那我们能做的就是不去刺激它们,让它们“长睡不复醒”。其实免疫系统也是这么想的,Weinberg 教授就发现,在小鼠中,免疫系统,更准确的说是 T 细胞的存在可以压制这些散装癌细胞向肿瘤发展。
给小鼠注射少量的乳腺癌细胞,比如 2.5×104 个,如果是免疫系统完整的小鼠,那只有 1% 会出现肿瘤。即使把癌细胞数量再提升一个数量级(1×105),也只有 30%,但对于免疫缺陷小鼠来说就是 100% 了。而没有了 T 细胞的小鼠,只需要 20 天,肿瘤的直径就能长到 12mm。
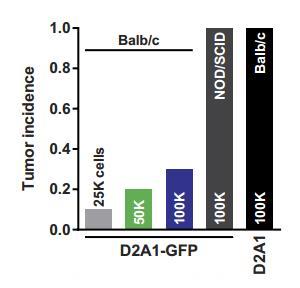
注射不同数量的癌细胞后肿瘤的发生率,从 2.5×104 到 1×105
既然即使不施加任何外力,T 细胞对它们的控制效果就很强,那到底是哪个不长眼的刺激了蛰伏的癌细胞呢?好吧,其实这都是炎症的错。首先我们要明确,这个炎症来自于手术的切口,它们伴随正常的炎症反应,作为伤口,它发红、发热、充血肿胀,这些都是炎症来过的痕迹。
Weinberg 教授查阅过去的临床研究发现,乳腺肿瘤切除术后,伤口愈合慢的出现转移性复发风险更大一些 [8],而在围手术期使用非甾体抗炎药物酮咯酸则能够降低患者的转移性复发风险[9]。这在包括阿片类药物在内的另外三种不同类型癌症镇痛药物种是都没有发现的。
Weinberg 教授团队自己的实验也观察到,模拟了手术伤口的小鼠与没有伤口的相比,肿瘤的发生率更高,体积也明显更大。
研究人员对这些小鼠的血液进行了分析,发现炎性单核细胞的水平大幅度增加,而非炎性单核细胞和淋巴细胞的水平则没有什么变化。单核细胞来源于造血干细胞,是体积最大的一类白细胞,也是免疫反应的重要参与者,在有炎症时水平升高,而且它属于未成熟细胞,可以继续分化成巨噬细胞。
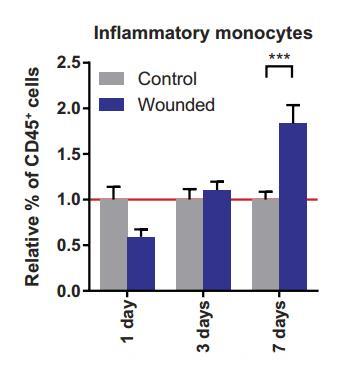
有伤口小鼠(蓝)和无伤口小鼠(灰)血液中炎性单核细胞在第 1、第 3 和第 7 天时占白细胞的比例,在第 7 天显著增加
咦?巨噬细胞?这不是癌症领域著名的墙头草吗?是了,这次的研究也发现,由癌细胞产生的趋化因子 CCL2 作用于炎性单核细胞,让它们分化成促进肿瘤生长的肿瘤相关巨噬细胞,看来又被策反了......
虽然伤口是不能避免的,但是抑制炎症我们有办法啊,研究人员给小鼠服用了非甾体抗炎药物美洛昔康,抑制了炎症反应后,伤口愈合的速度不会受到影响,而且和不服药的小鼠相比,即使长出了肿瘤,体积也要小得多,一部分免疫能力强的小鼠甚至还能将小肿瘤消灭掉。
这是第一个关于肿瘤切除术副作用的系统性证据,Weinberg 教授也表示,他们迈出的是重要的第一步,未来可能会使用像非甾体抗炎药物之类的作为联合治疗,以控制手术带来的副作用 [10]。
编辑神叨叨
副作用大家都怕,但是要正视它,而不是因噎废食,去寻求什么 “天人合一”
参考资料:
[1] Jordan A. Krall, et al. The systemic response to surgery triggers theoutgrowth of distant immune-controlled tumorsin mouse models of dormancy. Science translational medicine, 2018, 10(436):eaan3464
[2] http://wi.mit.edu/people/faculty/weinberg
[3] K. Pantel, R. H. Brakenhoff, B. Brandt, Detection, clinical relevance and specific biologicalproperties of disseminating tumour cells. Nat. Rev. Cancer 8, 329–340 (2008).
[4] Y. Hüsemann, J. B. Geigl, F. Schubert, P. Musiani, M. Meyer, E. Burghart, G. Forni, R. Eils,T. Fehm, G. Riethmüller, C. A. Klein, Systemic spread is an early step in breast cancer.Cancer Cell 13, 58–68 (2008).
[5] Harper K L, Sosa M S, Entenberg D, et al. Mechanism of early dissemination and metastasis in Her2+ mammary cancer[J]. Nature, 2016, 540(7634): 588-592.
[6] Hosseini H, Obradović M M S, Hoffmann M, et al. Early dissemination seeds metastasis in breast cancer[J]. Nature, 2016, 540(7634): 552-558.
[7] Linde N, Casanova-Acebes M, Sosa M S, et al. Macrophages orchestrate breast cancer early dissemination and metastasis[J]. Nature Communications, 2018, 9(1): 21.
[8] H. Dillekås, R. Demicheli, I. Ardoino, S. A. H. Jensen, E. Biganzoli, O. Straume, The recurrencepattern following delayed breast reconstruction after mastectomy for breast cancersuggests a systemic effect of surgery on occult dormant micrometastases. Breast CancerRes. Treat. 158, 169–178 (2016).
[9] Forget P, Vandenhende J, Berliere M, et al. Do intraoperative analgesics influence breast cancer recurrence after mastectomy? A retrospective analysis[J]. Anesthesia & Analgesia, 2010, 110(6): 1630-1635.
[10] http://news.mit.edu/2018/perioperative-nsaids-may-prevent-early-metastatic-relapse-in-post-surgical-breast-cancer-patients-0411










