读完这一本,吹牛吹一年!
作者丨鲸鱼
来源丨医学界内分泌频道
年关将近,自然是要温故而知新,总结一下这一年来的重要的学科进展,才能在新的一年里更好地工(ban)作(zhuan)呀!这不,我一点开Nature Review Endocrinology……
就...怂...了...

2017年,内分泌代谢领域光Nature Review就发布了七百多页综述文章,我一口气读到大年三十怕是要内分泌失调……

不过,Nature Review早就料到了这一点,从去年12月开始就逐步放出了一系列综述。这一系列囊括了心血管、内分泌、肿瘤、泌尿、肾脏、神经、风湿、消化等领域,总计44篇短文,均由受邀的专家撰写,回顾了去年各个领域的重大事件,涉及超过200篇文献,并于今年1月集结为电子书,供大家免费下载[1]。

Fig 0.1 电子书封面
其中,涉及内分泌领域(Endocrinology)的文章共有5篇[2-6],分别涉及了2型糖尿病管理、营养制剂与疾病、基因与生长疾病、健康和衰老中的免疫代谢以及人工胰腺的话题。
接下来,就让我们一起去畅游知识的海洋——电子书在手,内分泌我有!

一、2型糖尿病管理:心血管试验的结果
doi: 10.1038/nrendo.2017.179.

Fig 1.1 糖尿病患者的心血管风险管理
领域纵览
2型糖尿病患者常发生心力衰竭,其死于心血管疾病的风险是普通人群的2倍。不过,2017年一系列在2型糖尿病患者中开展的心血管临床试验的结果显示,SLUT2、ARNI等类型的药物可能具有降低心血管风险和改善血糖控制水平的双重作用。
关键进展
1.钠-葡萄糖协同转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor, SGLT2 )这类药物,能够降低2型糖尿病人因心血管事件死亡以及因心肌梗死、卒中、心力衰竭等心血管事件住院的风险;
2.血管紧张素受体/脑啡肽酶双重抑制剂(angiotensin receptor/neprilysin inhibitor, ARNI)相较于血管紧张素转换酶抑制剂(ACEI)在降低心力衰竭以及全因死亡风险的同时,还可以改善血糖控制;
3.靶向IL-1β的单克隆抗体Canakinumab,作为一种抗炎药物,被一开创性的研究报道可以降低心血管风险;
4.α-葡萄糖苷酶(α-glucosidase)抑制剂被证实可降低冠心病和糖耐量减低的中国人群新发糖尿病的风险。
未来展望
2017年,SLUT2抑制剂以及ARNI被证明具有控制血糖和降低心血管风险的双重作用,抗炎制剂也被报道能够改善心血管结局,这些发现在未来可能会改变糖尿病患者心血管风险的管理模式。在中国,α-葡萄糖苷酶抑制剂降低新发糖尿病的风险,可能有助于缓解中国糖尿病人群的进一步增长。
二、营养制剂:从莫须有到临床证据
doi: 10.1038/nrendo.2017.169.

Fig 2.1 营养制剂与内分泌疾病
领域纵览
营养制剂常以膳食补充剂或食品添加剂的形式出现,这些制剂通常会宣称其对健康有好处。2017年,临床证据显示某些制剂,或许的确能够用于2型糖尿病、代谢综合征、肥胖、血脂异常、骨质疏松等疾病,更多高质量的研究甚至可能会让某些营养制剂被选择性地纳入临床实践之中。
关键进展
1.营养制剂正在通过临床试验逐渐摆脱伪科学的帽子,虽然绝大多数的营养制剂的作用依然并未被循证医学证实,但有证据表明,大豆异黄酮(soy isoflavones)、益生元(prebiotics)、镁(magnesium)等营养制剂,可能对治疗或预防疾病有好处;
2.近年来,人们开始用科学的眼光去审视一些营养制剂的长期、普遍的看法,某些制剂,如白藜芦醇(resveratrol),被证明没有益处,甚至还会带来意想不到的危害,这体现了用临床试验测试这些营养制剂潜在作用的重要性;
3.在一定情况下,若某一疾病可供选择的药物不足或效果不佳,可以考虑将营养制剂作为一个选择,甚至可以考虑将这些制剂的使用纳入到指南或临床实践之中;
4.由于每种制剂都有不同的性质、作用机制和预期效果,在推荐它们用于临床之前,应当逐一权衡利弊。
未来展望
就像药物需要用证据来证明其有效性,各类营养制剂也需要用证据去评价。人们应当避免推荐使用益处未经证明、甚至可能有害的营养制剂,但同时也不能将这些制剂完全排除在现代医学之外。近来,有一些高质量的证据提示,某些营养制剂在短期内的确有一定效果。在未来,应该严格地开展各类营养制剂的临床试验,为是否使用这些制剂补充更多的证据。
三、遗传与生长疾病:从机制到治疗
doi: 10.1038/nrendo.2017.178.
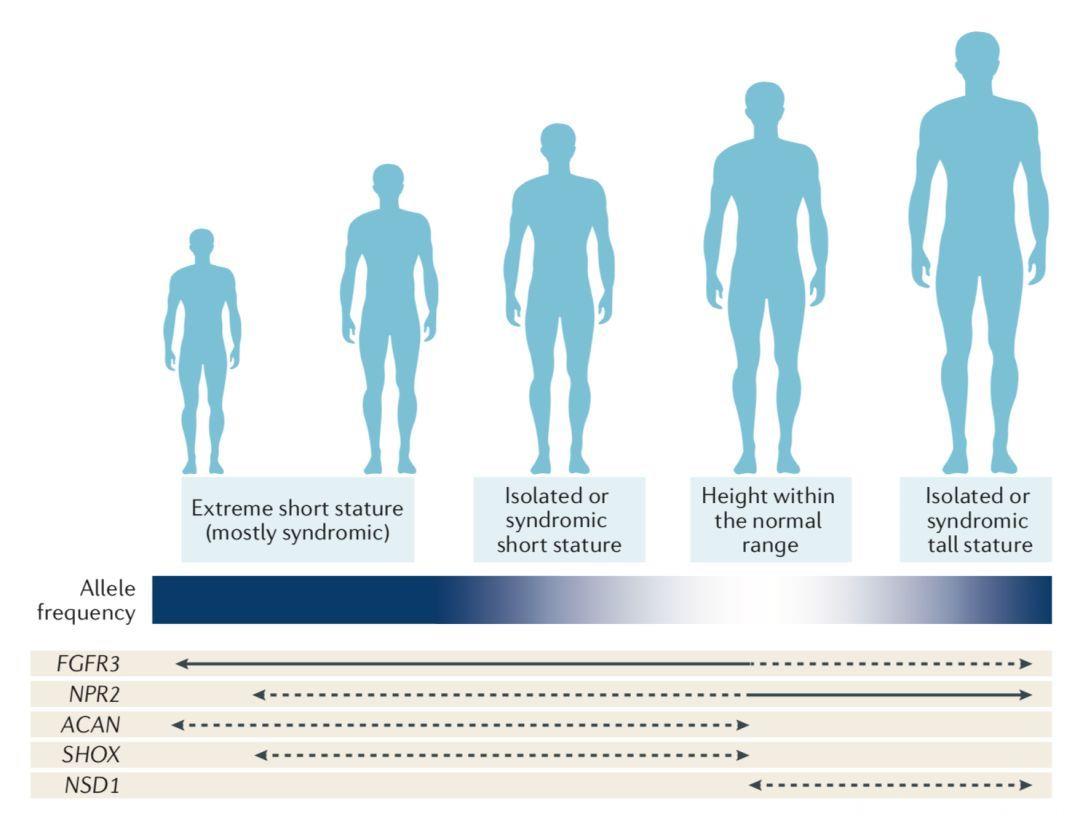
Fig 3.1 生长相关基因(实线:功能增强;虚线:功能丧失;深蓝:罕见;白色:常见)
领域纵览
针对罕见生长疾病的研究和对于成年人身高变异性基因的研究,一起揭示出了一个调节儿童生长发育的巨大基因网络。新技术、新模型将有助于破译这个复杂网络中的分子机制,并有望从中找到治疗生长发育疾病的全新治疗方法。
关键进展
1.全基因组关联分析(GWAS)的结果提示,FGFR3、NPR 等基因编码在骺板(growth plate)中有功能的蛋白质,其罕见变异,能够在成人身高变异中有中等到较大的影响;
2.与表观遗传学调控的紧密相关的一些基因突变是骨骼发育生长过快(overgrowth)、头颅巨大(macrocephaly)、智力发育迟滞(mental disability)的小儿巨脑畸形综合征(Sotos syndrome)的常见原因,如NSD1、EZH2、DNMT3A等;
3.Weaver综合征由编码polycomb抑制性复合体2(polycomb repressive complex 2, PRC2)亚基EZH2,、EED、SUZ126的基因杂合突变失去功能所引起;
4.SHOX基因缺陷的引起的生长障碍仅在编码视磺酸分解代谢酶(retinoic acid catabolizing enzyme)的CYP26C1基因变异作为遗传修饰子的情况下才完全表现出来,提示人们向由寡基因相关的生长障碍疾病迈进了一步。
未来展望
2017年,人们鉴定出了许多对于身高有较大影响的罕见基因变异;同时发现了表观遗传学相关的基因突变是小儿巨脑畸形综合征的常见原因;另外,人们还向寡基因调控的生长障碍疾病迈出了第一步。这些研究结果为生长障碍和其他骨骼疾病提供了新的治疗靶点。
四、健康和衰老:代谢与炎症的作用
doi: 10.1038/nrendo.2017.175.
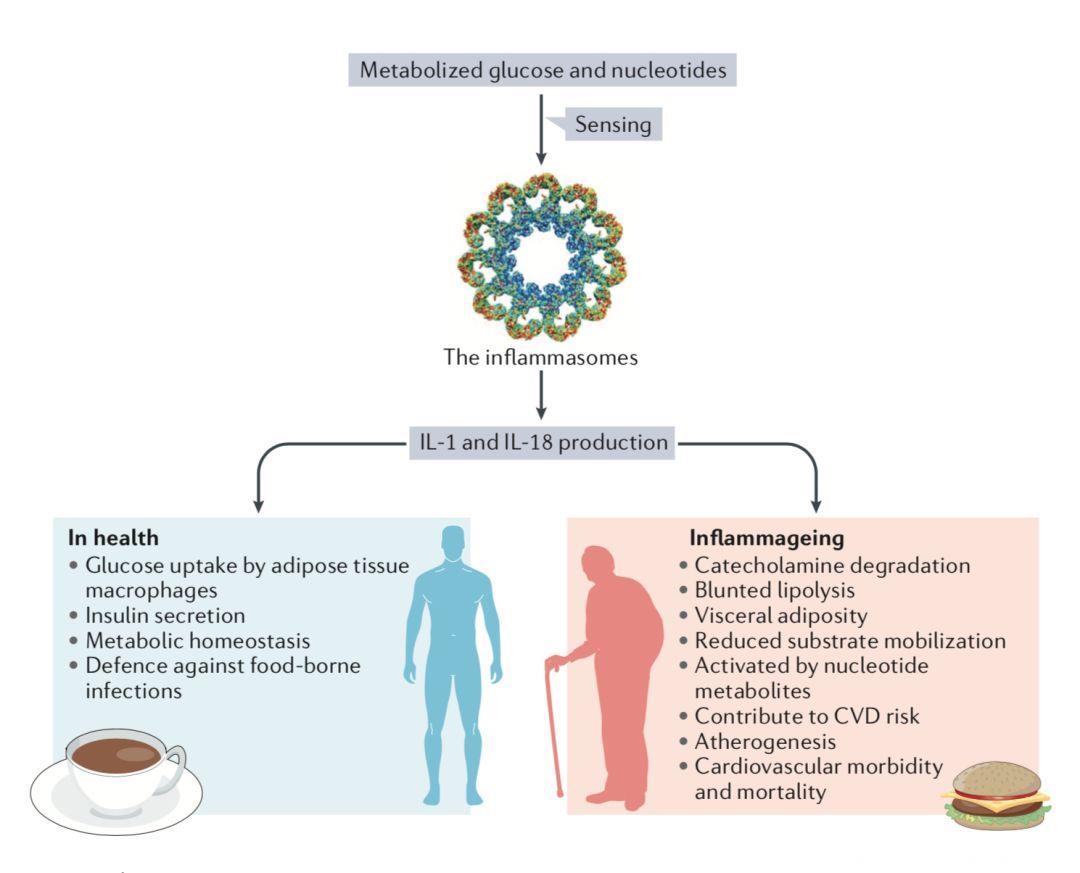
Fig 4.1 健康和衰老中的炎症与代谢
领域纵览
细胞外的危险相关分子模式(extracellular danger-associated molecular pattern)能够激活NOD样受体,但其具体机制尚不明确。NOD样受体蛋白家族的一个亚群——炎症小体(inflammasome)通过IL-1和IL-18介导将这些危险信号转化为炎症反应。2017年,代谢与炎症在健康和疾病中的作用被进一步阐明。
关键进展
1.炎症小体在正常情况下有助于维持葡萄糖稳态,比如健康人在进食后诱发的短暂低度炎症状态就有助于保证胰岛素敏感组织中有足够的营养物质用于代谢并保障了固有免疫细胞的功能;
2.随着衰老,炎症相关疾病也会逐渐增加,炎症小体能够促进儿茶酚胺类激素降解,减缓脂肪分解,不易动员脂肪,使得老年人更容易内脏脂肪堆积、运动耐量降低并且更不耐受寒冷;
3.核苷酸代谢物能够激活炎症小体,促进老年人高血压、血小板活化和动脉硬化的发生,而炎症小体活性测定可以用于心血管风险的预测;
4.中和炎症小体下游产物IL-1的治疗可以降低心血管疾病的发病率和死亡率。
未来展望
研究表明,短暂、受控的炎症小体激活有助于维持机体稳态,但长期、过度的炎症小体激活则是炎症性疾病的主要原因。不过,好在药物和饮食干预均可预防炎症小体过度激活的不良后果,如文中一项研究提到的,也许每天喝一杯咖啡就能让炎症小体远离你!
五、人工胰腺:从实验室到临床实践
doi: 10.1038/nrendo.2017.170.
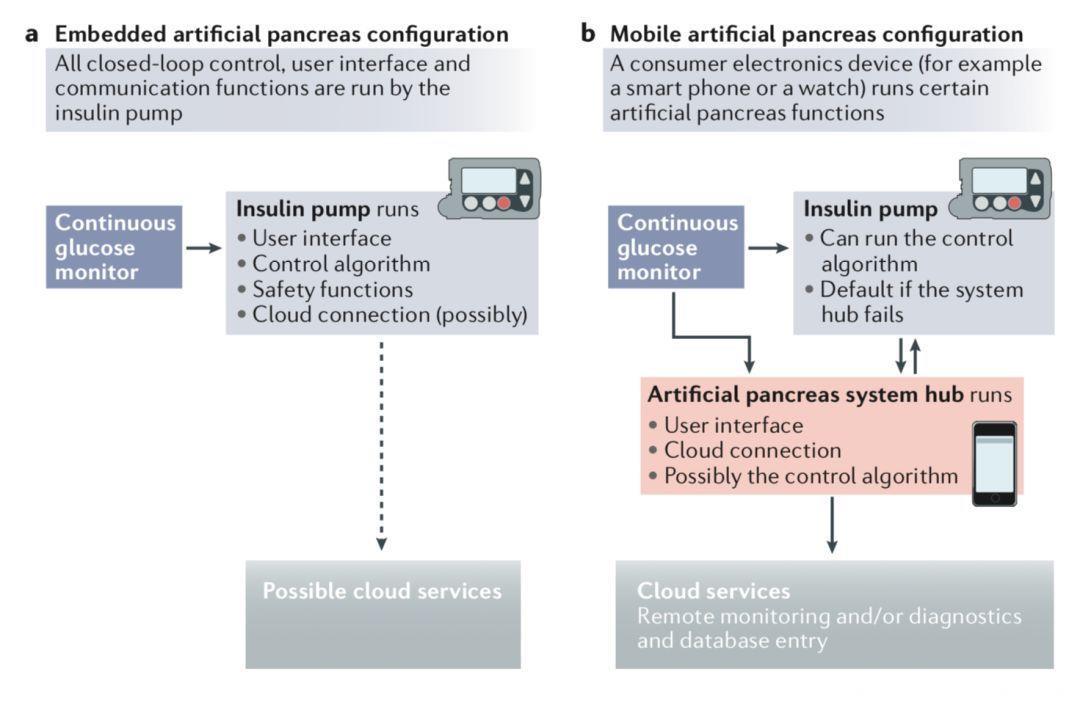
Fig 5.1 嵌入式和移动式人工胰腺
还记得这篇文章吗?)
领域纵览
自2011年首个人工胰腺在门诊病人中被成功应用以来,人工胰腺——糖尿病自动闭环控制系统日臻完善。2017年,这一系统在越来越严苛的环境下被测试,披露了一系列长期临床试验结果,并且出现了第一个获得批准的商用人工胰腺。这一技术从实验室走向了临床,造福了众多糖尿病患者。
关键进展
1.FDA批准第一个“人工胰腺”之后,这一领域从实验室走向了临床实践;
2.对自适应闭环控制算法的测试提示,这一系统能够根据每个人的代谢特点,在闭环运作期间持续地调整胰岛素的用量,显著改善血糖控制情况;
3.为了测试这一系统能否应对各种代谢紊乱情况,人们对其施加了诸如进食、运动等干扰,研究表明,这一系统甚至可以应对在寒冷、高空环境下、长时间滑雪运动所引起的代谢紊乱;
4.美国国立卫生研究院(NIH)支持了四项大型临床研究,希望能够使人工胰腺成为临床上可行的控制1型糖尿病的手段。
未来展望
本文涉及的研究均是人工胰腺发展史上里程碑式的突破。目前,在NIH支持的大型临床试验中嵌入式和移动式两种人工胰腺被囊括在内。在不久的将来,人工胰腺可能就会成为数字时代1型糖尿病治疗的重要手段!
Reference
[1] Springer Nature. Nature Reviews Key Advances in Medicine 2018. Available at:http://s3-service-broker-live-19ea8b98-4d41-4cb4-be4c-d68f4963b7dd.s3.amazonaws.com/uploads/ckeditor/attachments/8816/KAiM-jan18.pdf Last assessed on 2018-02-06.
[2] Rury R. Holman. (2018). Management of T2DM in 2017: Clinically relevant results from cardiovascular outcome trials. Nat Rev Endocrinol. 2018 Feb;14(2):67-68. doi: 10.1038/nrendo.2017.179. Epub 2018 Jan 5.
[3] Amanda J. Berberich & Robert A. Hegele. (2018). Nutraceuticals in endocrine disorders. Nat Rev Endocrinol. 2018 Feb;14(2):68-70. doi: 10.1038/nrendo.2017.169. Epub 2017 Dec 22.
[4] Ola Nilsson. (2018). Genetic and epigenetic regulation of childhood growth. Nat Rev Endocrinol. 2018 Feb;14(2):70-72. doi: 10.1038/nrendo.2017.178. Epub 2017 Dec 29.
[5] Thomas Mandrup-Poulsen. (2018). Metabolism and the inflammasome in health and ageing. Nat Rev Endocrinol. 2018 Feb;14(2):72-74. doi: 10.1038/nrendo.2017.175. Epub 2017 Dec 29.
[6] Boris Kovatchev. (2018). The year of transition from research to clinical practice. Nat Rev Endocrinol. 2018 Feb;14(2):74-76. doi: 10.1038/nrendo.2017.170. Epub 2017 Dec 22.









