对现有的糖尿病治疗进行微小的改变可以改变它们与细胞的相互作用,并有可能使药物更有效。
这一发现来自于人类细胞和老鼠的早期研究,研究人员调整了现有治疗2型糖尿病的结构。
这一调整使伦敦帝国理工学院的研究人员得以侵入“血液系统”,使药物进出细胞。这增加了药物的有效性,并导致更多的胰岛素被释放。
该团队包括一些国际机构,他们说,类似的方法已经被应用于开发其他现有药物的更有效的版本,包括疼痛治疗。这项技术还可能减少药物副作用的数量。
2型糖尿病患者无法有效控制血糖水平。最常用的药物叫做二甲双胍,但如果这种药物不起作用,或者引发副作用,患者通常会服用其他药物。其中包括一种叫做“肠促胰岛素”的药物,它可以刺激胰腺中特定细胞的胰岛素释放,称为beta细胞。
在最新的研究中,研究人员将注意力集中在这些化合物中的一种,一种叫做exenatide的药物,患者每天或每周注射两次,这取决于配方。这种化合物通过结合和激活一种叫做GLP-1受体的对接点,在细胞表面发现,刺激细胞释放胰岛素。
在本周发表在“自然通讯”杂志上的一篇论文中,研究人员解释了如何切换艾塞那肽的一些构建块可以产生具有略微不同性质的新化合物,改变它们与GLP-1受体相互作用并使药物更有效。
正常情况下,当GLP-1受体被激活时——比如像exenatide这样的化合物与它们结合,它们会从细胞膜转移到细胞内部,在那里它们要么被降解,要么被循环利用,即它们重新加入细胞膜,准备重新启动整个过程。这一过程被称为受体贩运,它对药物的作用和副作用的程度有很大的影响。
“在正常情况下,我们可能不希望细胞继续被激活,所以这些受体被内部化了,不再能够在细胞外自然发生GLP-1,”来自帝国理工大学Bloom实验室的本·琼斯博士解释道,他也是这项研究的第一作者。“然而,当你有一种疾病,我们可以从不断刺激的受体中获益,那么避免这种内在化过程可能是一种优势。”
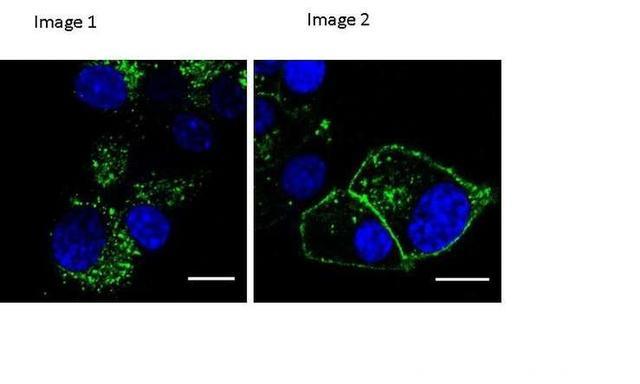
研究小组发现其中一种名为“exendin-phe1”的化合物改变了GLP-1受体的转运过程。在实验室的人体细胞试验中,他们发现他们的化合物降低了受体离开细胞膜的程度,从而导致细胞表面有更多的受体与药物结合。
通过标准的治疗,大约90%的GLP-1受体将从细胞膜转移到细胞中,只有大约10%的受体被循环利用。然而,在新的化合物中,只有30%的受体进入细胞,其中大部分被回收,回到细胞膜。
在小鼠的研究中,研究人员发现,虽然他们的新的化合物增加了胰岛素的分泌,从动物的胰腺β细胞,它似乎没有增加GLP-1受体身体其它部位的影响——即glp - 1在大脑受体,与恶心。
琼斯博士解释说:“我们已经开发了一种基于受体贩运的新机制,来开发一种对2型糖尿病更有效的药物,而这种药物似乎不会增加副作用的风险。”“如果这种疗法能让它进入市场,那么它的优势在于,与现有治疗相比,它可以更有效地治疗糖尿病,而且这种额外的疗效不会伴随着更大的恶心和其他副作用。”
根据研究人员的说法,调整药物以影响受体的贩运,可能会导致对现有治疗方法的改进。例如,吗啡可以通过瞄准体内的阿片受体来缓解疼痛,但它会产生一些非靶向性的影响,包括便秘和其他胃肠道效应,以及抑制呼吸系统。
通过改变阿片类药物的结构来改变受体的“偏置”(一种与人口贩卖有关的现象),研究人员在维持药物的止痛特性的同时,能够减少这些影响。
帝国团队正计划与健康的人类志愿者进行一项小规模的研究,以进一步探索受体贩运的机制及其如何使用,预计将在未来几个月开始。
Alejandra Tomas博士是盖伊·拉特教授的研究小组的讲师,也是这项研究的资深作者,他说:“我们发现,对药物分子进行微小的改变可以显著改变受体的转运。最终,我们有兴趣使用这些化合物作为工具来尝试和理解受体生物学,并在未来生成更有效的药物。(白木清水208454)