2018年3月15日/医麦客 eMedClub/--2017年12月30日,腾讯头条的新闻让很多人揪心:11岁女童小霖花白血病复发偷偷写“遗书”:妈妈我可能要失约了。
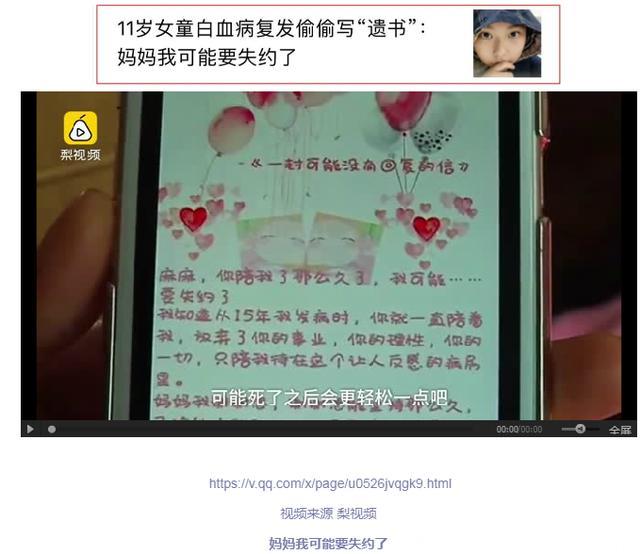
2015年7月,9岁的小霖花被诊断为急性B淋巴细胞白血病B-ALL(标危),经过治疗后在2017年3月复发,经过再次治疗获得第二次完全缓解。为了避免再复发,小霖花进行异基因造血干细胞移植,以获得最大的生存机会。但不幸的是,这一次的全面复发使得小霖花体内的肿瘤负荷物高达93%,也就是说,93%的细胞都是白血病细胞,这几乎已经宣告了小霖花的治疗走到了山穷水尽的地步。
CARVac
全球首试患者获完全缓解
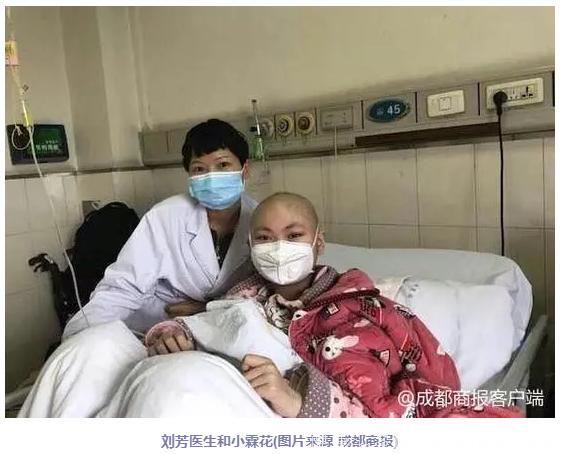
当时,成都军区总医院造血干细胞移植中心主任刘芳医生所在的团队负责人-纽约州立大学石溪分校(Stony Brook)的Yupo Ma(马鈓波教授),美国公司 iCell Gene Therapeutics 和归气丹生物医药(中山)有限公司总裁兼创始人有一项在研的Super CAR新型武器(在普通CAR-T进一步改进的一种新型武器 CARVac),其中马鈓波教授是该项技术的国际专利持有者。(普通CAR-T细胞相比,这种CAR-T细胞优势在于将肿瘤靶点和肿瘤疫苗相结合,除了通过肿瘤抗原介导的特异性杀伤,还会通过疫苗效应把全身免疫系统调动起来产生杀伤,使杀伤肿瘤效应更强烈更持久)

1月15日,在小霖花复发的第28天,刘芳医生对小霖花进行了CARVac细胞治疗。同时也是该项具有国际专利的药物在全球首次受试。
据相关负责人介绍,归气丹公司将新一代免疫产品CARs引入中国,在国家健康基地投资建设乙方亚太区总部,首期投资预计1.75亿美元,包括建立研发生产基地及亚洲免疫治疗中心,计划将获得美国一新型生物技术研发高科技公司独家授权的针对不少于10个特定病种CAR-T 产品临床研究和应用涉及专利的中国及东南亚使用权益授权给中山公司,将使癌症免疫治疗药物在中山实现产业化,填补国内在T细胞肿瘤、自身免疫性疾病等研究领域的空白。
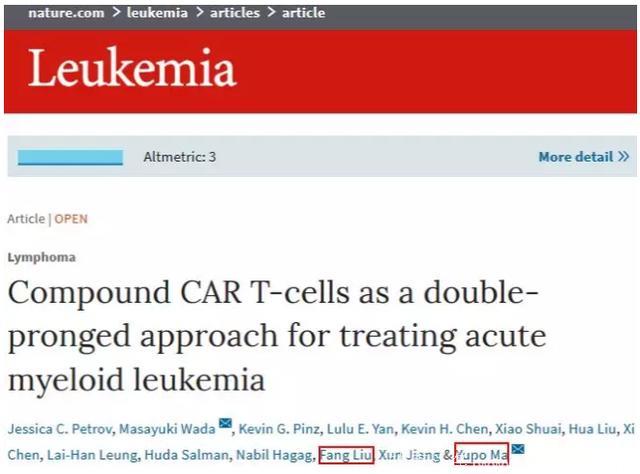
而除了以上提及的CARVac 细胞治疗之外,近日,由马鈓波教授所领导的研究团队还在权威学术期刊《Nature》子刊《Leukemia》上发表了一篇论文,详细介绍了一款针对急性骨系白血病(AML)的双靶点CAR-T细胞疗法。
新型CAR-T细胞
或能有效治疗AML
由于急性髓系白血病(AML)具有异质性细胞,因此其可以抵消单一CAR治疗的杀伤作用,从而导致疾病复发。其中与CD123表达相关的白血病干细胞(LSC)在该疾病进展和复发中也起重要作用。在这里,该研究团队报告了针对两种不同AML抗原CD123和CD33的离散scFv结构域的复合CAR(cCAR)T细胞的强大抗肿瘤活性。
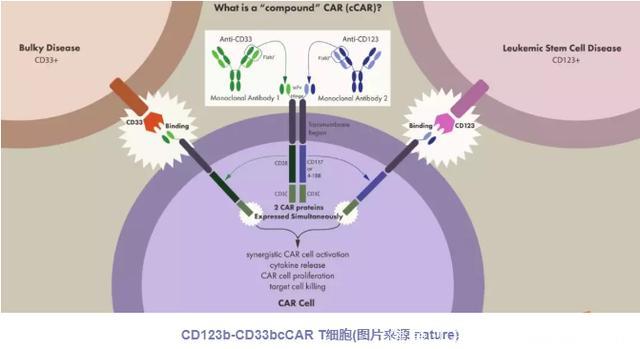
同时,研究人员确定其开发的cCAR T细胞对每种靶抗原群体具有一致的、有效的和定向的细胞毒性。体内实验结果显示:四种白血病小鼠模型在接受cCAR治疗后,获得了更长的存活时间。此外,该团队还设计了alemtuzumab(阿仑单抗))安全开关,可以快速终止体内cCAR治疗。研究结果表明针对AML细胞上的CD123和CD33抗原可能是消除AML巨块病变和LSC两者的有效策略,并且可能防止由于抗原逃逸或LSC持续而导致的复发。
众所周知,急性骨髓性白血病(AML)是一种骨髓性白细胞(而非淋巴性白细胞)异常增殖的侵袭性血癌,特点是骨髓内异常细胞的快速增殖进而影响正常血细胞的产生,导致感染和出血,危及生命。目前,异基因造血干细胞移植(HSCT)仍然是AML唯一可行的治疗选择,但只有少数患者能够从中获益。此外,50-70%的患者在化疗和HSCT后复发,5年生存率仅为27%。
而作为一种新型而强大的治疗方法,CAR-T已被证明可用作恶性血液病的治愈性治疗手段,其中疗效最显著的是以CD19和BCMA为靶点的针对B细胞淋巴瘤和浆细胞恶性肿瘤的CAR-T细胞疗法。然而,部分患者在接受治疗一年后经历了复发。因此,基于单靶点的CAR治疗或许不足以预防疾病的复发。因此,多种抗原的复合靶向才是改善CAR治疗结果的关键需求。
而一项成功的针对AML的CAR治疗,需要靶向的两种不同抗原应该具备以下条件:
(1)消除引起疾病复发的LSC(白血病干细胞)
(2)提供多个靶点的覆盖以限制单一抗原所导致的复发
其中,由于CD33在大量AML疾病中的特异性表达以及在正常细胞的最低限度表达,因此它一直是AML治疗的重要靶点。针对319例AML患者的一项研究发现:87.8%的AMLs表达CD33。
另外,CD123也广泛存在于AML的未成熟细胞中,同样的319例AML患者中,存在9.4%的AML表达CD123而不表达CD33。因此,同时靶向CD33和CD123可以防止与复发相关的抗原逃逸。
更重要的是,CD123在CD34+ CD38- LSC上显示高表达,并且在正常造血干细胞(HSC)上缺失或最低限度表达。而CD34+ CD38- 细胞被定义为LSCs,因为它们可以启动和维持免疫缺陷小鼠中的白血病过程,CD34+ CD38- CD123+ LSCs的数量可以预测AML患者的治疗结果。虽然AML是一种异质性疾病,但大多数AML样本表达CD33,CD123或两者。因此,靶向CD123和CD33将消除大多数患者的AML。
在这项临床前研究中,该团队设计了表达离散的anti-CD123和anti-C33 CAR单元的CD123b-CD33b cCAR,以在AML中同时靶向巨块病变和LSCs。研究结果显示,CD123b-CD33bcCAR(123b-33bcCAR)T细胞特异性消融体外和体内表达CD123和CD33中的任一种或两种的白血病细胞。我们还发现123b-33bcCAR在消除患者样品中的LSC和白血病母细胞中显示出显着的效力。作为防止cCAR高效的安全开关,我们制定了快速消除白血病小鼠模型中所有残留cCAR的策略。这项研究共同支持将123b-33bcCAR发展为有希望的AML免疫疗法。
研究结果
▪ CD123-CD33cCAR(123b-33bcCAR)T细胞的产生
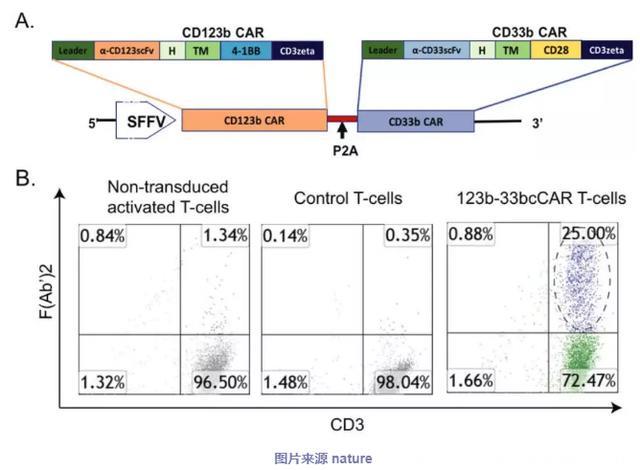
通过用图1a中所示的慢病毒构建体转导外周血T细胞,以产生123b-33bcCAR-T细胞。流式细胞术分析显示约25%的T细胞在转导后表达CD123或CD33 CAR F(Ab')2片段(图1b)。这种123b-33bcCAR被设计为通过靶向巨块病变和CD34+ CD38- CD123+白血病群体以消除活动性疾病,清除AML细胞并预防白血病复发。
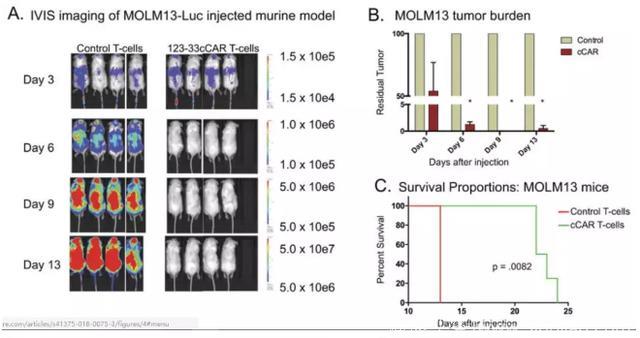
▪ 123b-33bcCART细胞在体内表现出强抗肿瘤活性
为了评估123b-33bcCAR T细胞的体内抗肿瘤活性,研究人员用表达萤光素酶的MOLM13(CD123+ CD33+)或U937(CD123- CD33+)细胞开发了两种小鼠模型以诱导荧光可见的肿瘤形成(图4a,d)。在注射MOLM13和U937的小鼠中,123b-33bcCAR细胞显著降低肿瘤负荷并延长了存活时间。此外,在对照组和123b-33bcCAR治疗组之间,两种异种移植模型中IVIS测量肿瘤负荷之间存在显著差异(P <0.0001)(图4b,e)。相比较于对照组小鼠,注射123b-33bcCAR T细胞的小鼠在第13天的肿瘤负荷降低了92-99%。此外,cCAR处理的小鼠也具有更显著的存活时间(图4c,f)。
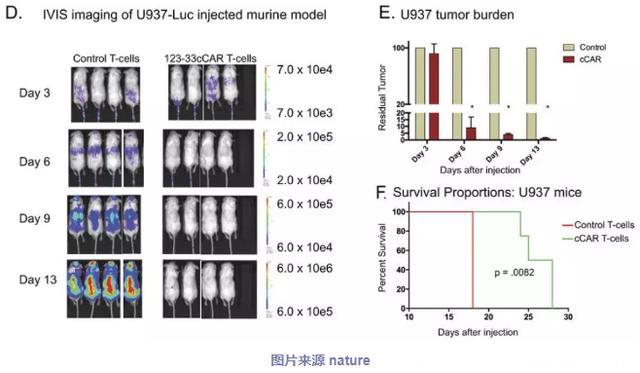
研究人员收集外周血并通过流式细胞术分析移植的肿瘤(MOLM13或U937细胞)和T细胞(cCAR或对照)的存在,以评估了CAR-T细胞持久性。结果表明:接受123b-33bcCAR治疗的小鼠具有显著的T细胞扩增和持久性,在外周血中发现的所有人细胞都是cCAR T细胞。而这些发现与观察到的强烈的抗白血病活性相关,并支持总生存期的显著改善。
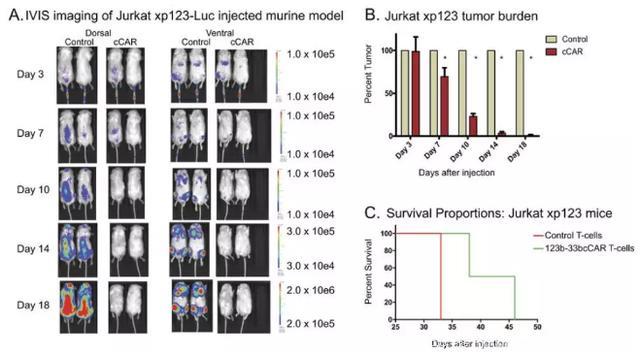
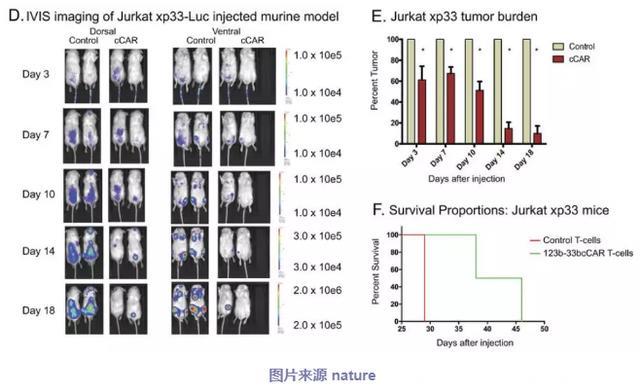
▪ 123b-33bcCAR T细胞在体内显示离散的抗原靶向能力
为了测定特异性CD123+ 或CD33+ 细胞的消耗并验证复合scFv的有效性,该团队建立了两个独立表达各抗原的人造肿瘤细胞的异种移植小鼠模型(Jurkatxp123或Jurkatxp33)(图5)。两组均用123b-33bcCAR和对照T细胞处理以测试123b-33bcCAR的独立抗原靶向能力。第7天,对照组和第123b-33bcCAR治疗组之间的肿瘤负荷有了显著差异(P <0.002)(图5b,E)。 到第18天,123b-33bcCAR处理的Jurkatxp123小鼠中的肿瘤细胞几乎不存在(<1%的肿瘤负荷),并且Jurkatxp33小鼠仅具有10%的残余肿瘤细胞。
▪ Alemtuzumab(阿仑单抗)可快速耗尽123b-33bcCAR T细胞
由于cCAR治疗可能会导致意外的副作用,因此,在紧急情况下,开发消除肿瘤耗竭后来自AML患者的123b-33bcCAR T细胞的安全方法可能是必要的。而T细胞在细胞表面表达CD52,CD52特异性抗体CAMPATH(alemtuzumab,阿仑单抗)则可以从循环中消除CD52 +细胞。
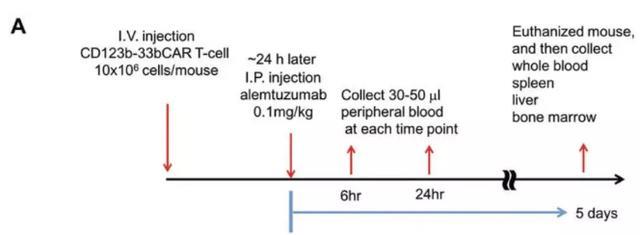
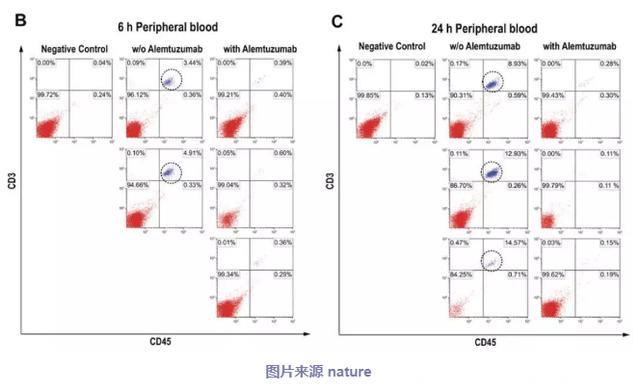
为了评估Alemtuzumab(阿仑单抗)介导的耗尽策略作为123b-33bcCAR T细胞的天然安全开关的可行性,该研究团队建立了全身注射123b-33bcCAR T细胞的小鼠模型。然后接受阿仑单抗治疗,并按照图6a工作流程中所述分析组织。在阿仑单抗给药6小时后,流式细胞术分析证实循环外周血中123b-33bcCAR T细胞的〜90%消耗(图6b),且48小时后耗竭速率增加至> 98% (图6c)。此外,阿仑单抗治疗后5天,几乎从外周血,脾脏,肝脏和骨髓中根除了123b-33bCAR T细胞。因此,阿仑单抗可快速有效地消除外周血中的cCAR T细胞以及组织浸润性cCAR T细胞。这些发现支持使用alemtuzumab作为天然安全开关来消除循环中的123b-33bcCAR T细胞。
结语
综上所述,为了提供更有效和全面的覆盖,以消除LSCs(白血病干细胞)和大巨变病块,并最大限度地减少抗原逃逸,该研究团队提出了一个结合CD123和CD33靶点的cCAR治疗。 值得注意的是,FDA已经授予了这种用于AML治疗的123b-33bcCAR的孤儿药资格认定(#17-6031)。
为了研究123b-33b双靶点CAR(123b-33bcCAR)的有效性,研究人员确定了其治疗AML可行性的三个标准。首先,其消除AML细胞系和患者肿瘤样品的基本细胞毒性功能。其次,每种离散cCAR单元在体外和体内独立靶向其抗原,并消除仅表达一种抗原或两种抗原的肿瘤细胞的能力。第三,治疗过程中能够快速完全终止体内的cCAR细胞。
毫无疑问,123b-33bcCAR为临床治疗AML提供了一个很好的机会。由于许多AML患者在诱导治疗和移植前短时间内复发,123b-33bcCAR T细胞成功地根除AML胚细胞和LSCs可能为治疗这些异基因干细胞移植患者提供了更好的机会。作为移植的桥梁,cCAR将以特定剂量施用,疾病状态将密切监测4-6周。一旦没有疾病证据,即开始准备异体移植物。患者将接受预处理方案,然后接受低剂量的阿仑单抗,最后进行干细胞移植。
此外,虽然目前通过CAR-T细胞靶向各种抗原的临床试验显示出了很大的希望,但是公开的数据有限。这些试验的初步结果表明单抗原方法可能并不足以有效的对抗AML。正如目前的治疗方案所证明的,一种消除包含最小残留病的LSCs同时也能够消除大量白血病的手段,对于长期有效的AML治疗是必不可少的。而马鈓波教授所领导的这项研究工作将推进双靶点CAR成为针对AML的一种新型的、强有力的治疗手段。

参考出处:
中山研发新药成功杀伤肿瘤细胞
doi:10.1038/s41375-018-0075-3
https://medicine.stonybrookmedicine.edu/pathology/faculty/ma