2018年3月3日/医麦客eMedClub/--近日,来自英属哥伦比亚大学的研究小组发现,10年前科学家还不知道,长期被忽略的一种罕见免疫细胞,可能是阻止癌细胞在体内扩散的有力武器。相关研究结果发表在Nature旗下期刊《Scientific Reports》上。
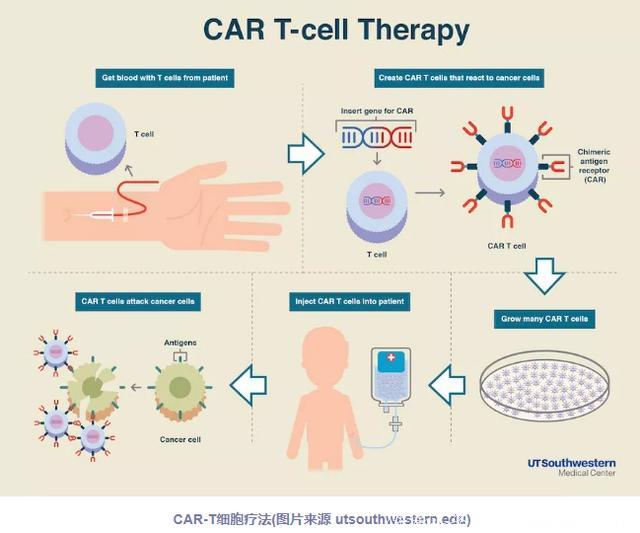
众所周知,现如今在肿瘤治疗领域大火的莫过于以CAR-T为代表的细胞免疫疗法了。这过去的短短几年时间里,这种旨在利用人体自身免疫系统来攻击癌细胞的突破性疗法已经取得了里程碑进展。大量的临床实验表明,其针对包括淋巴瘤在内的部分恶性血液肿瘤具有强大的治疗潜力,但在治疗实体瘤方面却有待商榷。

2016年,遗传医学与微生物免疫学系的Wilf Jefferies教授发现,缺乏白细胞介素33(IL-33)的癌症细胞,对于免疫系统是“不可见”的。因此,这类癌细胞能够顺利逃脱免疫系统的监视,进行增殖和转移。基于该研究基础,Wilf Jefferies教授将重点目标放在了被IL-33激活的细胞,ILC2(2型先天性淋巴细胞)上了。
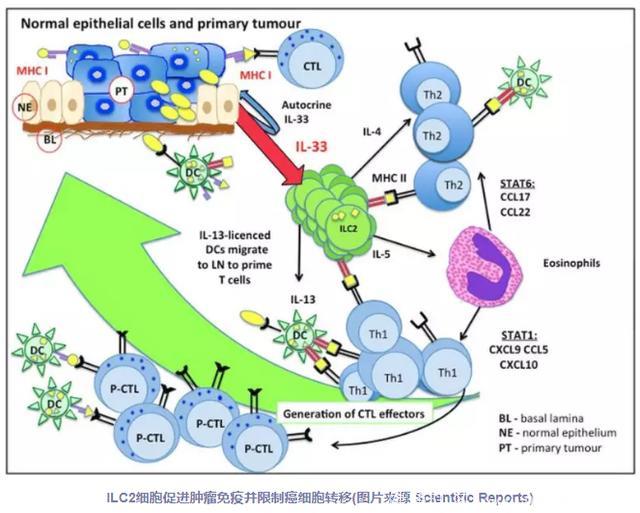
最初,科学家们是在研究哮喘的发病机制时发现的ILC2细胞,表明ILC2细胞与这种自身免疫性疾病的发病密切相关,固有免疫应答的关键部分能引起呼吸道炎症。但是,像大多数免疫细胞一样,ILC2细胞也可能具有负面和正面作用。
在进一步的研究中,Jefferies博士及其在英属哥伦比亚大学Michael Smith实验室的团队在缺乏ILC2细胞的基因工程小鼠体内植入了肺癌细胞。最初,他们所关注的焦点是,相比较于含ILC2细胞的正常对照组小鼠,缺少LC2细胞的实验组小鼠体内癌细胞的生长速度是不是更快。
不出所料,实验证明:缺少LC2细胞的小鼠体内的癌细胞的生长速度的确扩增的很快。但与此同时,更引人注意的是,Jefferies博士和Fumio Takei教授发现:基因工程小鼠和对照组之间最大的区别是癌症在体内扩散的部位。
在基因工程小鼠体内,注射部位通常保持原位不动的原发性肺癌细胞会变成“可移动的”,出现在包括肺、脑、肾上腺和淋巴组织等多个部位。与此同时,癌细胞的转移几乎不受任何限制,研究表明:相比较于对照组,基因工程小鼠脑部的癌症细胞数量要高出1000倍。
Jefferies博士和他的团队认为ILC2细胞通过释放杀伤性T细胞,在预防和减缓肺癌和前列腺癌的转移方面扮演着重要的角色,换句话说,ILC2是能够杀死癌细胞的另一种类型的免疫细胞。
目前,Jefferies正在完成该实验的另一部分,即通过向小鼠体内注射ILC2细胞,能否阻止植入癌细胞的扩散。作为温哥华前列腺中心免疫肿瘤学的负责人,Jefferies认为,如果改研究结果在动物模型中植入人体细胞得到了进一步验证,就为测试ILC2细胞注入癌症患者体内,是否能够减缓扩散提供了依据。
另外,Jefferies教授表示还看到了IL-33蛋白在注射测试方面的潜力,目前,IL-33蛋白是由盈利性实验室里进行合成的,目的是观察它是否能触发病人自己储存ILC2细胞。
由于不需要被特定的肿瘤抗原激活,也就是让免疫细胞发起攻击的一种标记物,因此ILC2细胞或能够成为极具应用前景的细胞疗法。这意味着,在使用这种治疗方式时,ILC2细胞不同于CAR-T,不需要经过实验室操作这一过程。
对此,Jefferies表示,“这些结果提高了利用免疫系统对抗癌症的可能性,可能是更有效地触发IL-33的ILC2细胞,或者仅仅因为拥有更多的ILC2细胞,或者是两者结合的情况。”
在此之前,科学家已经了解到了ILC 2(2型先天淋巴细胞)能够增强免疫反应,然而,它们在癌症中介导的适应性免疫的作用尚未被评估。这项新的研究表明:缺乏ILC2细胞的小鼠具有显著增加的肿瘤生长速率、显著更高的循环肿瘤细胞(CTCs)频率以及导致远端器官的转移。研究数据支持IL-33依赖肿瘤浸润的ILC2细胞,通过趋化作用从肺和其他组织动员进入肿瘤,并随后通过与树突细胞协作促进适应性T细胞应答来介导肿瘤免疫监视的模型。我最终得出结论:ILC2在增强抗癌免疫力和控制肿瘤转移方面发挥了基础性的,但迄今未被描述的作用。

参考出处:
https://www.nature.com/articles/s41598-018-20608-6
http://www.med.ubc.ca/an-under-the-radar-immune-cell-shows-potential-in-fight-against-cancer/
医麦客 丨出品
中国生物医药产业新媒体
转载请联系:[email protected]
申明:文中资讯内容和事件评述仅代表作者观点,如果出现与事实不符或版权侵犯的内容,请速与医麦客平台联系,我们会尽快做出处理,欢迎更多读者朋友关注并给出指导建议。












