美国时间2月21日新英格兰医学杂志(NEJM)在线发表了广谱抗癌新药larotrectinib(LOXO-101)同时进行的三项安全性和有效性研究数据,研究结果显示对于年龄为4个月至76岁的患者,针对17种不同癌症治疗总体反应率为75%,这无疑令人振奋!
本次公布的数据为larotrectinib同时进行的三项安全性和有效性研究,包括成人I期研究,儿童I-II期研究,以及青少年和成人II期研究(NCT02122913,NCT02637687和NCT02576431)。Larotrectinib的数据非常喜人,有望成为第一个口服、针对17种不同肿瘤、儿童和成年人都可以用的广谱靶向药。我们一起来了解一下它的详细情况。
研究设计
从2015年3月到2017年2月,研究人员分析了55例参加了3项正在进行的I期、II期临床试验的TRK基因融合患者的数据。
患者年龄从4个月到76岁不等,全部患者(12例儿童,43例成人)患有包括阑尾癌,乳腺癌,胆管癌,结直肠癌,胃肠道间质瘤(GIST),婴儿纤维肉瘤,肺癌,黑色素瘤,胰腺癌,甲状腺癌等17种肿瘤。
这些患者通过检测手段确定属于NTRK1、NTRK2或者NTRK3融合,之前进行过治疗。主要研究终点为总反应率。次要终点包括反应持续时间,无进展生存期和安全性。
研究结果
根据迄今为止评估的55例出现TRK异常融合患者(包括TRKA (NTRK1) (45%),TRKB (NTRK2) (2%), TRKC (NTRK3) (53%),通过NGS(50例)和FISH(5例)检测。)总反应率为75%,总共13%的患者(7名患者)完全缓解,62%(34)的患者部分缓解,13%(7)的患者病情稳定,9%(5)的患者有进行性疾病,4%(2)由于临床恶化提前退出而未被评估。
疗效方面,总体有效率为75%,1年时71%患者仍有治疗反应,55%患者无进展。中位随访9.4个月,85%患者正在接受治疗或接受了旨在治愈的手术。通过下面瀑布图看到,高达78%患者的肿瘤显著缩小。对于存在TRK异常的患者,疗效广泛并持久。
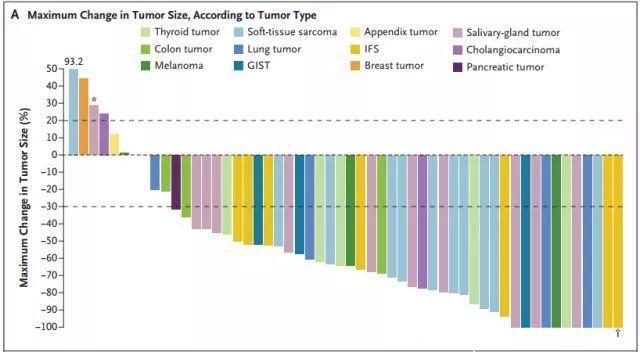
图A:不同肿瘤类型尺寸的最大变化
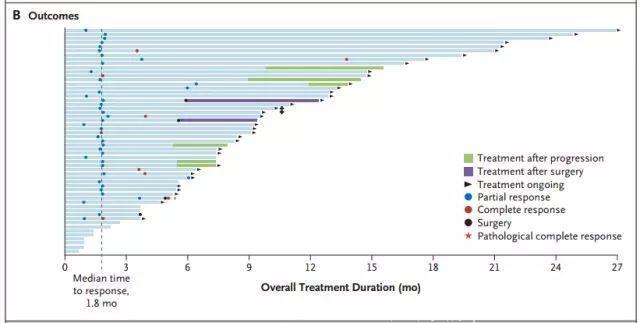
图B:所有患者结果
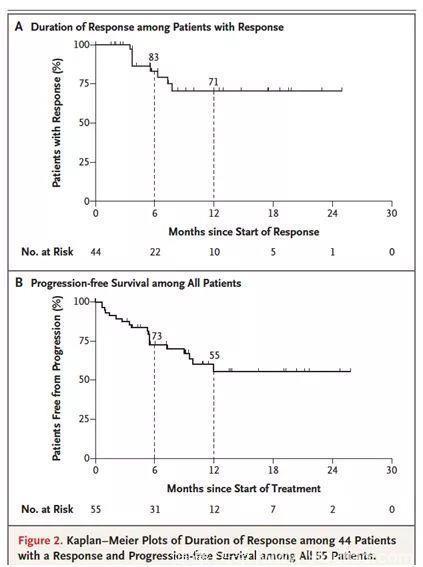
在中位随访8.3个月后,总体人群的中位DoR尚未达到,见下图2A;中位随访9.9个月后,总体人群的中位PFS尚未达到,如下图2B。在治疗1年后,71%的患者仍有响应,55%的患者疾病无进展。至研究截止日期,86%(38/44)的取得客观缓解的患者,后续接受了其他治疗或根治性手术。目前,疗效持续时间最长的是第1例入组的患者,在27个月时仍在接受治疗。
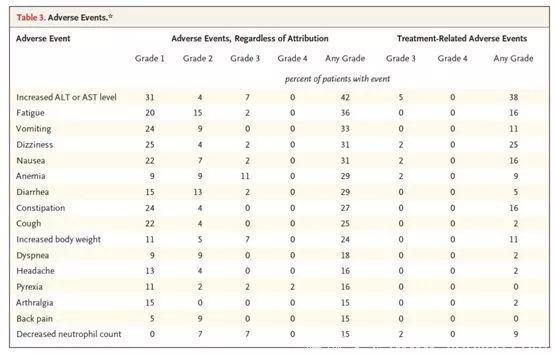
治疗中出现的不良事件大多为1级,研究人员认为3级或4级不良事件与larotrectinib相关,发生率超过5%。没有患者因为药物相关的不良事件而停用larotrectinib。
最常见的不良事件是贫血(11%),丙氨酸转氨酶或天冬氨酸转氨酶水平增加(7%),体重增加(7%)和中性粒细胞计数减少(7%)。
鉴于Larotrectinib较高的ORR,研究者对原发耐药的患者进行潜在耐药机制分析。共6例(11%)患者的最佳疗效为PD,其中1例患者既往接受过另一个TRK抑制剂治疗,对Larotrectinib治疗前后的肿瘤组织进行测序发现激酶ATP结合区有NTRK3 G623R突变。NTRK3 G623R突变及其旁系同源NTRK1 G595R突变被称为“solvent-front”突变TRK,这一突变会干扰了Larotrectinib与TRK蛋白的结合。
其余5例患者,3例进行了TRK蛋白的IHC检测,结果发现肿瘤组织中未见TRK蛋白表达,这提示入组时当地实验室检测可能存在假阳性,抑或这些TRK基因融合并没有导致蛋白表达,这也解释了这些患者接受Larotrectinib治疗无效。
研究者同时还探索了Larotrectinib获得性耐药的机制。10例取得PR或SD>=6个月的患者并且出现疾病进展的患者,9例进行了再次活检或取得血浆标本。进展后的标本检测到多个激酶区突变,包括NTRK1 G595R或NTRK3 G623R突变(7例患者),NTRK1 F589L突变(2例)和NTRK1 G667S或NTRK3 G696突变(2例)。10例获得性耐药的患者,8例(80%)患者在第一次进展后,研究者认为患者仍有临床获益,继续接受Larotrectinib治疗。
研究结论
在这一研究项目中,高选择性的TRK抑制剂Larotrectinib在TRK融合成人和儿童实体瘤中显示出高效持久的疗效。这一研究精准地定位了TRK融合基因,对合并TRK融合基因的不同癌种患者实现了“异病同治”的效果,为肿瘤精准治疗再添新证据。
Larotrectinib是第一个真正意义上的tissue-agnostic的靶向治疗,即根据肿瘤共同的异常,而不是肿瘤部位进行研发。关于突变相关靶向治疗,几乎大多靶向治疗只是有效,但疗效持续的时间不长,复发率高。但从目前有限的数据来看,无论患者的年龄或肿瘤类型如何,Larotrectinib对TRK融合阳性的癌症患者似乎不仅仅是有效,而是持久的疗效。
2017年12月底,Larotrectinib已经开始向美国FDA提交上市申请,用于治疗带有NTRK融合基因的成人或儿童实体瘤患者,预计2018年初完成申请,然后等待FDA批准——就现有的数据而言,FDA很有可能会加速通过它。也就是说在2018年上半年,Larotrectinib就很可能会在美国本土上市。DavidHyman博士表示,如果审批通过,larotrectinib将会成为第一个在成人和儿童中同时开发和批准的治疗方法,并且是第一种跨越所有传统定义的肿瘤类型,分子意义上的肿瘤靶向治疗。
如何申请Larotrectinib临床试验?
目前Larotrectinib仍未上市,想要试用该药物需入组相关临床试验方可,临床试验入组的首要条件是先进行基因检测,确认存在NTRK基因突变!
目前展开的临床研究有:
1、NTRK融合阳性实体瘤患者LOXO-101(Larotrectinib)的研究
这是一项针对携带NTRK1,NTRK2或NTRK3融合基因的晚期实体瘤患者的II期多中心开放标记研究。LOXO-101将以100mg每日两次(BID)口服给药,连续给药28天为1周期。
该研究将分析8个患有NTRK融合肿瘤患者的队列,包括非小细胞肺癌,甲状腺癌,肉瘤,结肠直肠癌,唾液腺癌,胆管癌和原发性CNS肿瘤。
实验地点:
1)加州大学洛杉矶分校
2)麻省总医院
3)斯坦福大学等
2、口服TRK抑制剂LOXO-101(Larotrectinib)用于治疗晚期小儿实体或原发性中枢神经系统肿瘤
这是一项多中心,开放标签,1/2期研究,用于晚期实体或原发性CNS肿瘤的儿科患者。LOXO-101(larotrectinib)将每日两次口服(PO)(BID),剂量通过体表面积(BSA)调整。
实验地点:
1)波士顿儿童医院
2)纪念斯隆凯特林中心
3)辛辛那提儿童医院医疗中心等
Larotrectinib耐药后怎么办?
科学家经过研究,发现Larotrectinib耐药机理和EGFR情况很像,主要是靶点本身(TRK基因)产生了新的突变,比如TRKA出现G595R突变,或者TRKC出现G623R突变。
根据这个发现,第二代TRK靶向药物LOXO-195已经出炉,专门来对抗耐药新突变。
结果十分乐观!
昨天关于第二代TRK靶向药物的论文刚刚发表,最初的两位耐药患者尝试新药后,肿瘤再次快速缩小。比如下面这位,用药一个月后,耐药的肿瘤就再次几乎消失!
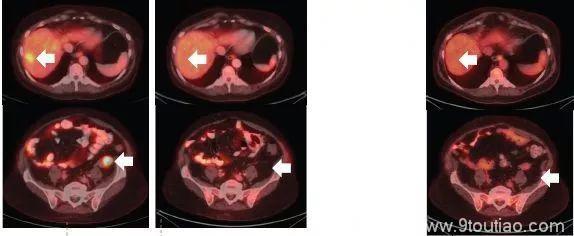
耐药后使用2代药一个月后
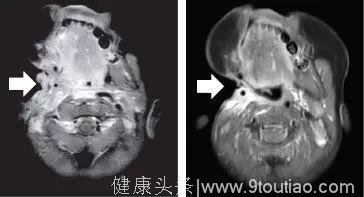
LOXO-195上个月已经被FDA批准正式开展临床试验,耐药患者有了新希望。
美国抗癌新药物的上市一定将为重症患者带来更多的可能性,同时,厚朴方舟也希望这些抗癌新药早日来到中国患者身边,为中国患者的健康保驾护航。
参考文献:
1.Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children.N Engl J Med. February 22 2018.
3.https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/OncologicDrugsAdvisoryCommittee/UCM516803.pdf
4.https://www.clinicaltrials.gov/ct2/show/study/NCT02576431?cond=Larotrectinib&rank=1&show_locs=Y#locn
5.https://meetinglibrary.asco.org/record/144598/abstract
6.file:///C:/Users/admin/Downloads/Targeting%20NTRK%20fusion%20in%20non-small%20cell%20lung%20cancer_%20rationale%20and%20clinical%20evidence.pdf
7.https://www.loxooncology.com/docs/press-releases/Loxo_ASCO_Data_Release_Embargoed_FINAL.pdf