除了免疫治疗药物外,更多的抗癌新药将在中国上市,包括靶向药、小分子抑制剂等除此之外,CAR-T生物疗法也在国内外蓬勃发展,展望2018年,我们有理由相信,会有更多的抗癌新药尽快与广大肿瘤病友见面,造福于更多的病患家庭。
如此算来,在2018内有望上市的抗癌新药大概有20款之多,以下按照癌种加以整理,供大家参考。
肺 癌
1. 针对非小细胞肺癌的小分子抑制:安罗替尼
2017年3月16日,自主研发的盐酸安罗替尼治疗非小细胞肺癌的上市申请获得CDE受理,走特殊审批通道,并于4月27日被CDE纳入优先审评,预计将2018年获批上市。
安罗替尼是一种口服的新型小分子多靶点TKI,可强效抑制VEGFR、PDGFR、FGFR和c-Kit 等多个靶点,具有抗肿瘤血管生成和抑制肿瘤生长的作用。
对于一线、二线治疗失败的中国晚期非小细胞肺癌患者,安罗替尼的面世,为晚期非小细胞肺癌三线治疗带来突破。
乳 腺 癌
2.针对乳腺癌的小分子抑制剂:吡咯替尼
2017年8月24日,自主研发的1.1类EGFR/HER2抑制剂马来酸吡咯替尼片的上市申请获得CDE承办受理,2017年9月26日,被CDE纳入优先审评。
目前申请的适应症主要为Her-2阳性转移性/晚期乳腺癌、Her-2突变的晚期非小细胞肺腺癌、Her-2表达阳性晚期胃癌。其中以乳腺癌适应症为主,已经进入Ⅲ期临床。
3. 针对早期乳腺癌的国产单抗帕妥珠
2018年1月2日,重磅乳腺癌药物帕妥珠单抗(Perjeta)在中国的上市申请获得CDE承办受理,并且已经获得CFDA优先审批的资格。
早在2012年6月,帕妥珠单抗就被FDA批准,联合曲妥珠单抗(赫赛汀)和多西他赛用于未接受过抗HER2治疗或化疗的转移性乳腺癌。
2013年9月,帕妥珠单抗又被FDA加速批准,与曲妥珠单抗、化疗联用,用于HER2+乳腺癌的新辅助治疗。
2017年12月20日,FDA批准帕妥珠单抗与曲妥珠单抗、化疗联用,用于复发风险较高的早期HER2+乳腺癌患者的辅助治疗。同时将帕妥珠单抗之前用于HER2阳性乳腺癌新辅助治疗由加速批准转为完全批准。
曲妥珠单抗+帕妥珠单抗+化疗已被全球超过75个国家批准用于HER2阳性乳腺癌的新辅助治疗,成为HER2阳性乳腺癌患者的标准治疗。
肝 癌
4. 针对亚洲肝细胞癌的靶向药:仑伐替尼
2017年11月3日,甲磺酸仑伐替尼胶囊治疗肝细胞癌的上市申请(JXHS1700042)获得CDE承办受理。2017年12月被CDE纳入优先审评。
2015年获美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于侵袭性、局部晚期或转移性分化型甲状腺癌的治疗, 并于2016年FDA和EMA相继批准仑伐替尼联合依维莫司治疗晚期肾细胞癌。
仑伐替尼是一种多靶点激酶抑制剂,可以阻滞肿瘤细胞内包括VEGFR1-3、FGFR1-4、PDGFRα、KIT、RET在内的一系列调节因子。
在REFLECT研究中国,仑伐替尼组总生存期非劣效于索拉非尼(13.6个月 vs. 12.3个月,风险比(HR)为0.92,95%置信区间 [CI] = 0.79-1.06),达到研究的主要终点。
对于中国大陆、台湾、香港患者亚群,观察到了更显著的疗效,特别是对于HBV相关肝癌患者,仑伐替尼的总生存期显著优于索拉非尼且安全可控。
5. 针对难治性肝细胞癌的CAR-GPC3T细胞制剂
2017年12月28日,目前唯一针对实体瘤的CAR-T治疗药物CAR-GPC3T细胞制剂新药注册获得CDE的批准。2017年12月底,科济生物向上海市食品药品监督管理局递交了临床研究申请,很快被受理。
目前市场上还没有治疗实体瘤的CAR-T细胞制剂,科济生物率先开发了针对GPC3靶点的CAR-T细胞,用于治疗难治复发的干细胞癌,目前有十余名难治性复发的肝癌患者接受了治疗,其中2人已“无病生存”27个月。
科济生物还按照我国GMP(药品生产质量管理规范)标准,已经建立了3100平方米的细胞制备中心,以确保CAR-T产品的制备质量。
结 直 肠 癌
6. 针对晚期结直肠癌的小分子抑制剂:呋喹替尼
2017年6月30日,呋喹替尼治疗晚期结直肠癌的上市申请获得CDE承办受理,2017年9月4日以“具有明显临床价值;重大专项”的理由被CDE纳入优先审评。
呋喹替尼III期临床研究FRESCO是迄今为止中国最大规模的针对晚期结直肠癌的关键性临床研究。呋喹替尼有望成为晚期结直肠癌患者的新选择。
FRESCO研究显示无论既往是否接受过抗VEGF或抗EGFR治疗,呋喹替尼组均能显著获益。同时,呋喹替尼的安全性良好。呋喹替尼(Fruquintinib)是一种高选择性的VEGFR长效抑制剂,适应症包括结直肠癌及非小细胞肺癌。
卵 巢 癌
7. 针对晚期卵巢癌的进口靶向药:奥拉帕利
2017年12月1日,全球首个卵巢癌PARP抑制剂奥拉帕利(Olaparib)在中国递交的上市申请正式获得CDE承办受理。
奥拉帕利最早在2014年12月被FDA加速批准,用于四线治疗晚期BRCA+卵巢癌。2017年7月17日奥拉帕利被FDA批准用于铂类药物治疗产生应答后疾病复发的成人卵巢上皮癌、输卵管癌和原发性腹膜癌患者的二线维持治疗。
2018年1月,FDA批准了奥拉帕利新的适应证,用于治疗携带BRCA突变的HER2-转移性乳腺癌患者。奥拉帕利成为首个、也是唯一获批能用于卵巢癌领域之外治疗的PARP酶抑制剂。
黑 色 素 瘤
8. 针对黑色素瘤的PD-1单抗:Keytruda
2018年2月11日,PD-1单抗Keytruda(帕博利珠单抗注射液)的上市申请(JXSS1800002)获得CDE承办受理。此次提交上市申请的适应症是黑色素瘤,这也是Keytruda在美国率先上市的适应症。
Keytruda目前在国内共登记开展了8项Pembrolizumab相关的临床试验,涉及肺癌、黑色素瘤、胃癌、食管癌、肝细胞癌等5大肿瘤类型。
2017年5月被FDA批准用于治疗携带高度微卫星不稳定性(MSI-H)或者错配修复缺陷(dMMR)的实体瘤患者,成为首款不是基于肿瘤发病位置而是基于肿瘤标记物的癌症治疗方法。
9. 针对晚期黑色素瘤的PD-1单抗:Opdivo
2017年11月1日,PD-1单抗Opdivo(Nivolumab)的上市销售申请获得CDE承办受理。2017年12月被CDE纳入优先审评。
Opdivo最早于2014年7月在日本获得批准,用于治疗晚期黑色素瘤,成为全球首个获批上市的PD-1/PD-L1类药物。
2014年12月22日,Opdivo获得FDA批准上市,用于治疗无法手术切除或已经出现转移且对其它药物无应答的晚期黑色素瘤患者。
Opdivo目前获批9个适应症包括黑色素瘤、非小细胞肺癌、肾细胞癌、经典型霍奇金淋巴瘤、头颈癌、尿路上皮癌、结直肠癌、肝细胞癌、胃癌。
白 血 病 淋 巴 瘤
10. 针对经典型霍奇金淋巴瘤的信迪单抗
2017年12月13日,信达生物制药(苏州)有限公司(简称“信达生物”)的抗PD-1单克隆抗体注射液“信迪单抗”上市申请(CXSS1700038),获得CDE受理,成为首个申请上市的国产PD-1单抗。
信迪单抗注射液代号IBI308,申请适应症为霍奇金淋巴瘤。除此适应症之外,IBI308还在进行非小细胞肺癌 、食管癌以及NK/T细胞淋巴瘤临床研究,主要用于治疗晚期实体瘤。
11-19 .针对白血病淋巴瘤的9种CAR-T生物制剂
CAR-T(ChimericAntigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法,在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。
国内申报临床的9个CAR-T产品的临床申请被药品审评中心受理,适应症多以白血病淋巴瘤等血液肿瘤为主,见下图(点击查看大图)。
广 谱 抗 癌 药广谱靶向药有望今年上市!
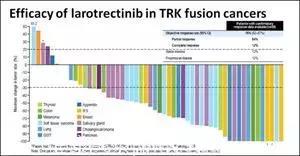
《新英格兰医学杂志》(N Engl J Med)2018年2月21日在线发布,拜耳公司针对17种肿瘤的抗癌新药Larotrectinib(LOXO-101)的最新研究数据。Larotrectinib是第一个口服、针对存在NTRK1、NTRK2或NTRK3基因融合的乳腺癌、胆管癌、结直肠癌、胃肠道间质瘤(GIST)、婴儿纤维肉瘤、肺癌、黑色素瘤、胰腺癌、阑尾癌、甲状腺癌等17种肿瘤的高选择性TRK抑制剂,可用于年龄4个月至76岁的儿童和成人病人,抗肿瘤客观有效率高达75%,而且安全性好。这无疑是新春过后肿瘤治疗进展最振奋人心的重磅好消息。此前Rossy也为大家整理过详细数据:
权威发布!针对17种肿瘤的传奇抗癌药LOXO-101最新研究数据公布!有效率75%!
以上抗癌技术及新药,均可通过全球肿瘤医生网咨询及评估,详情致电医学部(400-666-7998)
声明:
本公众号内容仅作交流参考,不作为诊断及医疗依据,仅依照本文而做出的行为造成的一切后果,由行为人自行承担责任。专业医学问题请咨询专业人士或专业医疗机构。











