今天,美国FDA刚刚批准了Gilead Sciences公司产品新药Vosevi(sofosbuvir 400 mg/velpatasvir 100 mg/voxilaprevir 100 mg)用于治疗慢性丙型肝炎病毒(HCV)成年患者,他们无肝硬化(cirrhosis)症状或仅患有轻度肝硬化。本文威正翔禹/缔一生物为您分析今天FDA批准泛基因型丙肝新药组合Vosevi。
适用患者群体为先前用含有NS5A抑制剂方案治疗失败的基因型1、2、3、4、5或6成年病人,以及先前使用含有sofsbuvir但无NS5A抑制剂方案失败的基因型1a或3成人。Vosevi是一种含三种固定剂量成分的组合药片,其中两种为先前获批药物sofosbuvir和velpatasvir,以及一个新药物化学分子voxilaprevir(泛基因型NS3蛋白酶抑制剂)。针对先前已经接受过直接抗病毒药物sofosbuvir或NS5A抑制剂治疗的患者,Vosevi是首个获得FDA批准的治疗方案。
▲Sofosbuvir(左)和 velpatasvir(右)的分子式(图片来源:wikipedia)
丙型肝炎是一类引起肝脏炎症的病毒性疾病,可导致肝功能下降或肝功能衰竭。根据美国疾病控制和预防中心(CDC)统计,美国范围估计有270至390万人口感染慢性HCV。一些患有多年慢性HCV感染的患者可能会出现黄疸(黄色眼睛或皮肤)症状,并涉及机体出血、腹部积液、感染、肝癌甚至死亡等并发症。目前,至少发现了六种不同基因型的HCV菌株,它们是遗传定义上不同的病毒类群。约有75%的HCV美国患者为基因型1;20-25%为基因型2或3;少数患者感染基因型4、5或6。

▲泛基因型NS3蛋白酶抑制剂voxilaprevir的分子式(图片来源:wikipedia)
研究人员在两个3期临床试验(POLARIS-1和POLARIS-4)中评估了Vosevi的安全性和有效性,其中涉及约750名没有肝硬化症状或轻度肝硬化的成年病人。与安慰剂比较,第一项试验评估12周疗程的Vosevi治疗HCV基因型1感染成年患者,他们先前接受NS5A抑制剂药物治疗失败。HCV基因型2、3、4、5或6的患者也都接受了Vosevi。在第二项临床试验中,与先前获批药物sofosbuvir+velpatasvir治疗方案相比较,评估了12周疗程的Vosevi治疗基因型1、2或3的成年患者,他们曾使用sofosbuvir(但非NS5A抑制剂)治疗失败。两项试验结果表明,96-97%接受Vosevi的患者在完成治疗后12周没有在血液中检测到病毒,表明患者的病毒感染已经被治愈。FDA曾经向Vosevi这一方案颁发了优先审评资格和突破性疗法认定。
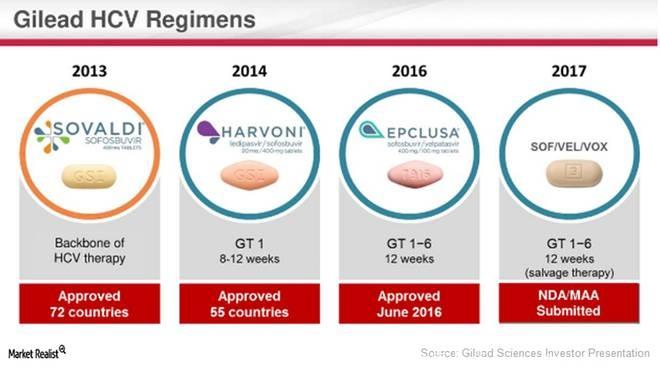
▲近年来Gilead Sciences公司获得批准的HCV新药组合(图片来源:Market Realist)
目前,针对特定HCV患者人群的挽救治疗(salvage therapy),Vosevi是首个获批的每日一次单片治疗方案,也完善了Gilead Sciences公司基于sofsbuvir的HCV直接作用的抗病毒(DAA)治疗组合。
FDA药物评估与研究中心下属的抗菌药物办公室主任Edward Cox博士说道:“直接作用的抗病毒(DAA)药物往往可以防止病毒繁殖并常常治愈HCV。但有些患者不能从中获益,Vosevi为这些未能成功获得治疗的HCV患者提供了治疗选择。”
威正翔禹生物(缔一生物)科技有限公司十多年来(viansaga.com)始终专注于生物医疗、细胞培养、生物制药等方面的技术支持及产品引进开发,是目前国内此领域最为专业的代理公司。主要代理产品澳洲进口Ausbian血清,支原体污染防治,液体培养基,支原体祛除检测剂,微生物培养基,细胞培养试剂,细胞分离液,动物细胞培养,DNA污染防治,微生物工业品,疫苗检测,生物科研试剂等。