
质子泵抑制剂(Proton pump inhibitors, PPIs)可能是在心血管科最常用的非心血管药物。
作者丨MajorTom 郑博
审稿丨北京大学第一医院心血管内科 郑博副教授
来源丨壹周冠脉
相较于其它抑制胃酸分泌的药物(组胺H2受体拮抗剂、毒蕈碱受体拮抗剂),PPIs的作用更加直接,直接抑制壁细胞的H-K-ATP酶活性,减少H离子的分泌,从而降低胃液PH。而尽管H2受体拮抗剂(如西咪替丁)在夜间有着强大的效果,但由于阻断的是促进胃酸分泌的多条信号通路之一,因而在使用后可能因为其他途径的代偿性激活而产生耐药。毒蕈碱受体拮抗剂(如阿托品)更是因为其全身效应而应用受限。
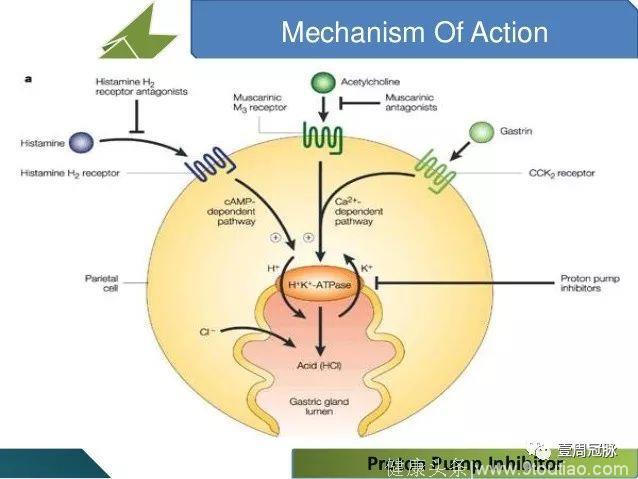
图片来自Google
不同质子泵抑制剂的特点
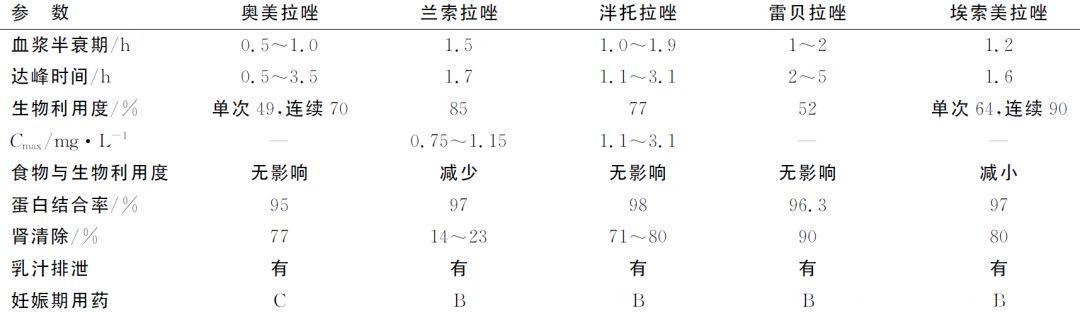
刘波,西北药学杂志, 2014
抑酸作用比拼
埃索美拉唑对胃酸分泌的抑制作用明显高于其他。雷贝拉唑的解离指数pKa为5,而兰索拉唑、奥美拉唑、泮托拉唑的解离指数pKa分别为3.9、4.0和3.8。对于PPIs来说,在胃酸性的环境中,pKa越大,解离越彻底,抑酸效果越好。
起效时间比拼
雷贝拉唑与酶的结合位点最多,故其作用快而持久,雷贝拉唑快速活化可在5 min内达到最大抑酸效果,兰索拉唑要45 min才能达到同一水平,而奥美拉唑与泮托拉唑在45 min时,仅达到其80%和50%。
持续时间比拼
口服埃索美拉唑、奥美拉唑各40mg后,胃液pH>4维持12h以上的百分比分别为50%和34%,第5天增至88%和77%,表明埃索美拉唑比奥美拉唑抑酸作用强。通过对健康志愿者研究,表明口服埃索美拉唑(40mg)比兰索拉唑(30mg)、雷贝拉唑(20mg)具有更好的抑酸作用。
当胃内pH值大于4以上,止血药物才能有效地发挥作用,pH>6.0时血小板才能发挥聚集作用,抑制胃蛋白酶诱导的凝血块溶解,有利于上消化道出血的治疗。因此在治疗上消化道出血时,持续时间非常重要。
抗板与消化道出血风险
2000年发表在BMJ上的一篇纳入24篇RCT研究、约66000名患者的META分析显示,平均随访28个月后,单纯使用阿司匹林抗板会增加一倍的消化道出血风险(2.47% vs 1.45%)。尽管单纯氯吡格雷对消化道出血的效果不明显,但与阿司匹林合用时仍然会继续增加阿司匹林的消化道出血风险。
PCI后因为多种抗板与抗凝药物的应用,消化道出血的风险更高,目前的多项研究表明术后短期内消化道出血风险约2%。
目前为止的研究也都证明了PPIs对双联抗板时消化道出血的有效性,2010年的一篇META分析认为大约可降低一半风险。
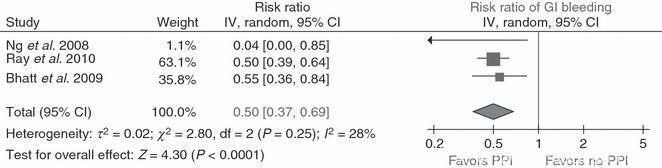
Sillermatula, Journal of Thrombosis & Haemostasis, 2010
PPIs与抗板药物
因为PPIs代谢主要经过CYP2C19(雷贝拉唑除外,泮托拉唑也较少),因此会竞争性抑制CYP2C19的活性。而氯吡格雷作为前体药物,需要经过CYP2C19活化才能起效,因此PPIs对于氯吡格雷活化的影响可能降低抗血小板的有效性。
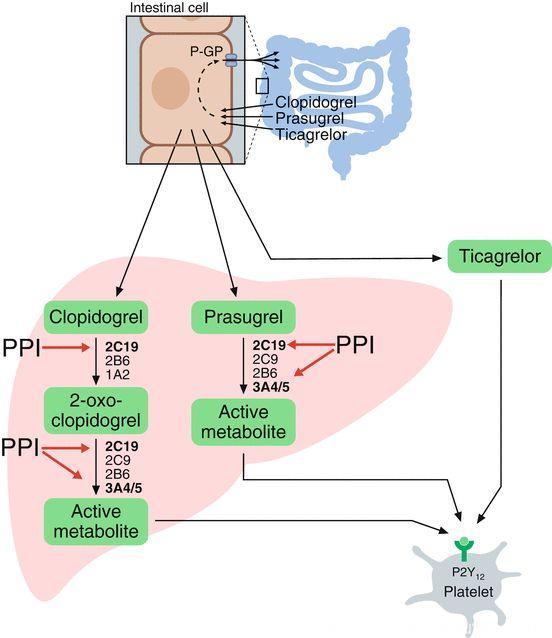
Würtz, Advances in Experimental Medicine and Biology, 2016
2009年发表在《Lancet》上的一篇综述提到了PPIs对于氯吡格雷有效性的影响。在使用PPIs的患者中,无论是对于负荷剂量还是长期应用,血小板抑制率合格的比例明显低于不使用PPIs的患者。
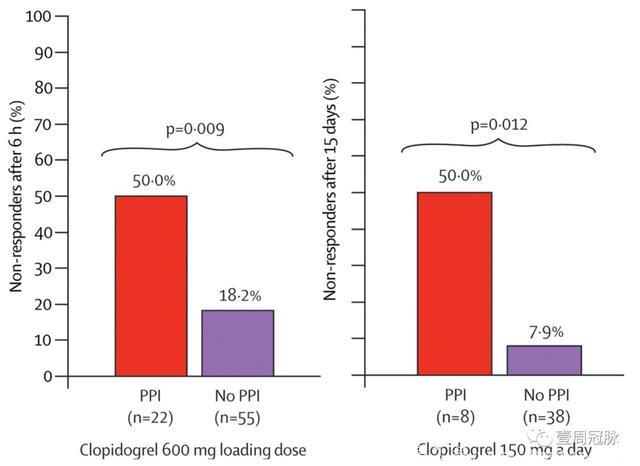
O'Donoghue, Lancet, 2009
2010年发表的一篇纳入25个研究、共159138名患者的META分析表明,同时使用氯吡格雷与PPIs相比单纯使用氯吡格雷,的确会显著增加MACE的风险,但并不增加死亡风险。
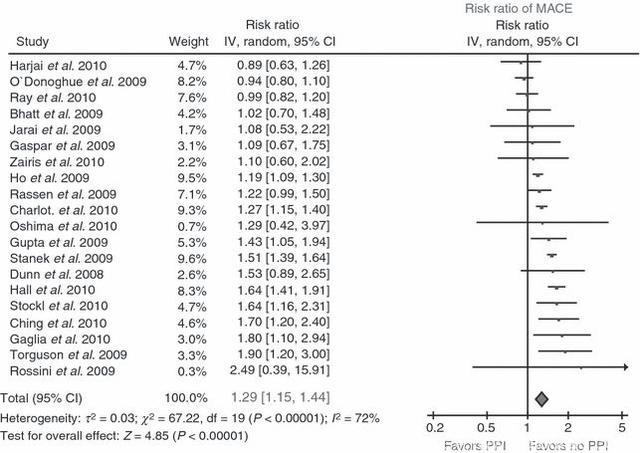
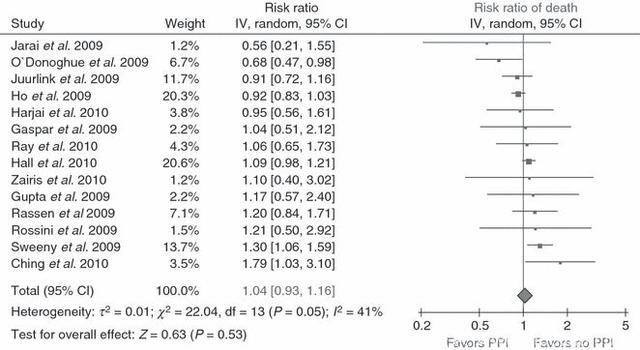
Sillermatula, Journal of Thrombosis & Haemostasis, 2010
如果说2010年发表的META分析参考价值有限的话,近期发表的一篇纳入2012-2016年11个研究的META分析也得出了同样的结论,联合应用氯吡格雷+PPIs会增加MACE率,但不会增加远期死亡率。
不过,2010年发表在《NEJM》上的一篇RCT研究纳入了3873名使用氯吡格雷的患者,随机进入奥美拉唑20 mg Qd或安慰剂组,结果发现两组的消化道出血具有显著差异(p<0.001),而心血管事件没有差异(p=0.98)。
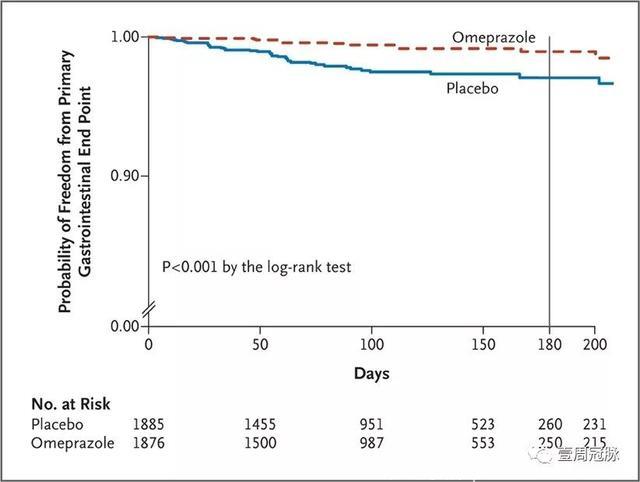
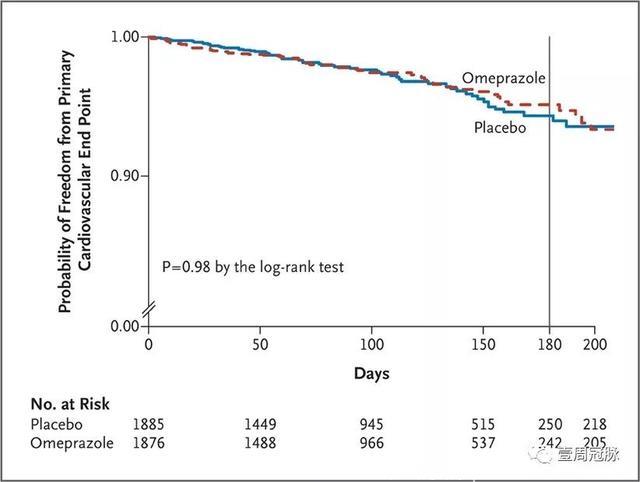
Bhatt D L, New England Journal of Medicine, 2010
可能的原因是尽管PPIs降低了氯吡格雷的抗板效应,但却因为降低了消化道出血的风险、增加了患者对氯吡格雷顺应性而获益。另外一方面,研究的随访的时间也较短。
根据2017年ESC的双联抗血小板(DAPT)指南,PPI被列为减少消化道出血的I类推荐。

对于另外的抗血小板药物(阿司匹林、替格瑞洛、普拉格雷等),目前的临床研究并没有发现影响。
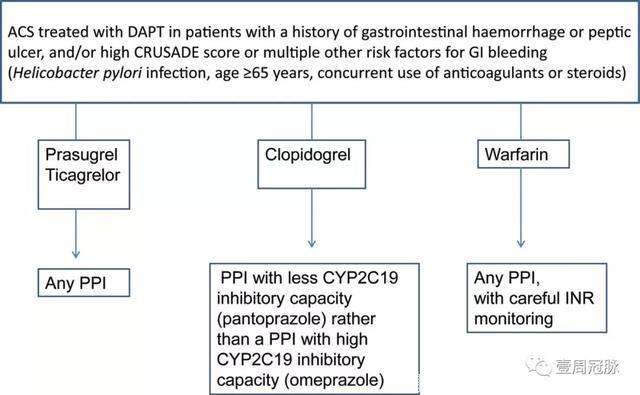
ACS患者的PPIs选择,Agewall, European Heart Journal, 2013
目前在应用阿司匹林、替格瑞洛、普拉格雷抗板治疗的患者中,并不限制PPIs的种类。但在使用氯吡格雷的患者中,有专家认为应尽可能使用CYP2C19较弱的竞争性抑制剂(雷贝拉唑、泮托拉唑)。
PPIs的心血管外副作用
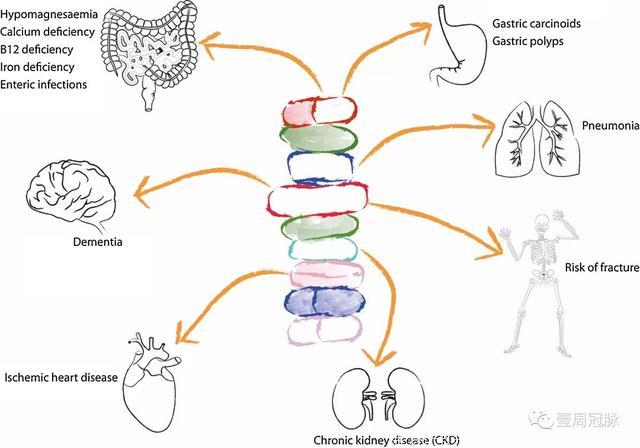
Savarino, Digestive & Liver Disease, 2016
除了心血管系统外,PPIs还可能具有其它系统的副作用。
消化系统
①镁缺乏
PPIs目前已被证实可以阻碍肠道的镁吸收。如果患者在使用PPIs期间出现癫痫发作或心律失常,需要考虑存在这种可能。
②钙缺乏
PPIs导致的胃酸分泌减少可能会使钙离子无法从不溶的钙化合物中释放,影响钙的吸收。如果长期使用PPIs,还可能增加骨折的风险。
③铁缺乏
膳食中的铁主要为三价铁离子,很难溶于PH>3的环境中,因此很难经过反应转化为二价铁。PPIs导致的低酸环境在一些研究中认为会导致患者血色素下降。
④维生素B12缺乏
PPIs导致的低酸环境使B12很难与其它蛋白分离,因此B12很难与内因子结合,导致吸收障碍。不过维生素B12在体内的储备量一般很高,很少导致不良后果。
⑤肠道菌群失调
低酸的胃液对细菌的杀伤性降低,导致肠道菌群的失调,特别是容易产生艰难梭菌感染。
⑥胃泌素增高
在PPIs影响H离子分泌后,会反馈性导致胃泌素水平升高,导致胃类癌、胃癌、胃息肉的产生。
神经系统
PPIs在动物试验中观察到了可能会影响淀粉样蛋白的代谢。在人类的大型前瞻性队列研究中也发现了PPIs使用者阿尔兹海默症患病率明显升高。目前需要大型的RCT研究来印证这一假想。
呼吸系统
目前的大型META分析发现PPIs使用者社区获得性肺炎(CAP)患病率显著升高,可能与胃内低酸环境导致的细菌增殖、吸入肺内有关,尤其在开始使用的第一个月,CAP的风险可能增加超过一倍。
另外,PPIs与其他药物一样,也可能会导致肾损害,多表现为急性间质性肾炎(AIN)和慢性肾脏病(CKD)。
参考文献:
【1】Sachs G, Shin J M, Howden C W. Review article: the clinical pharmacology of proton pump inhibitors[J]. Alimentary Pharmacology & Therapeutics, 2006.
【2】刘波, 姚鸿萍. 临床常用质子泵抑制剂的研究进展[J]. 西北药学杂志, 2014(3):328-330.
【3】刘鹏. 质子泵抑制剂的研究进展[J]. 临床合理用药杂志, 2014, 30(35):96-97.
【4】Agewall S, Cattaneo M, Collet J P, et al. Expert position paper on the use of proton pump inhibitors in patients with cardiovascular disease and antithrombotic therapy.[J]. European Heart Journal, 2013, 34(23):1708-1713.
【5】O'Donoghue M L, Braunwald E, Antman E M, et al. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomised trials.[J]. Lancet, 2009, 374(9694):989-997.
【6】Sillermatula J M, Jilma B, Schrör K, et al. Effect of proton pump inhibitors on clinical outcome in patients treated with clopidogrel: a systematic review and meta-analysis.[J]. Journal of Thrombosis & Haemostasis Jth, 2010, 8(12):2624.
【7】Savarino V, Dulbecco P, Savarino E. Are proton pump inhibitors really so dangerous?[J]. Digestive & Liver Disease Official Journal of the Italian Society of Gastroenterology & the Italian Association for the Study of the Liver, 2016, 48(8):851-859.
【8】Würtz M., Grove E.L. Proton Pump Inhibitors in Cardiovascular Disease: Drug Interactions with Antiplatelet Drugs. In: Islam M. (eds) Thrombosis and Embolism: from Research to Clinical Practice. Advances in Experimental Medicine and Biology, 2016.
【9】Tanigawa T, Watanabe T, Nadatani Y, et al. Gastrointestinal bleeding after percutaneous coronary intervention.[J]. Digestion, 2011, 83(3):153-160.
【10】Bundhun P K, Teeluck A R, Bhurtu A, et al. Is the concomitant use of clopidogrel and Proton Pump Inhibitors still associated with increased adverse cardiovascular outcomes following coronary angioplasty?: a systematic review and meta-analysis of recently published studies (2012 – 2016):[J]. Bmc Cardiovascular Disorders, 2017, 17(1):3.
【11】Sukhovershin R A, Cooke J P. HOW MAY PROTON PUMP INHIBITORS IMPAIR CARDIOVASCULAR HEALTH?[J]. American Journal of Cardiovascular Drugs Drugs Devices & Other Interventions, 2016, 16(3):1-9.
【12】Eusebi L H, Rabitti S, Artesiani M L, et al. PROTON PUMP INHIBITORS: RISKS OF LONG‐TERM USE[J]. Journal of Gastroenterology & Hepatology, 2017, 32(7):1295.
【13】Bhatt D L, Cryer B L, Contant C F, et al. Clopidogrel with or without omeprazole in coronary artery disease.[J]. New England Journal of Medicine, 2010, 363(20):1909.










