来源:中国医疗器械信息杂志
内容提要:本文对中国、欧盟、美国、日本及GHTF 的口腔材料的分类进行了整理,比较并分析了我国口腔科材料与国外同类产品的管理类别分类界定情况。
关 键 词:口腔科材料 医疗器械 分类目录
0.
引言
医疗器械产品分类目录是医疗器械监管法律法规体系中重要的基础性法规之一,一个科学、恰当的分类目录,即医疗器械产品管理类别与其风险相对应对于保证医疗器械产品安全、有效同时又能促进医疗器械行业健康可持续的发展具有十分重要的意义。本文旨在通过整理介绍我国、IMDRF(GHTF)、欧盟、美国、日本等国的口腔科材料的分类管理情况,并对此进行了简单分析和对比,为我国口腔材料的监管、分类目录的制订提供参考。
1.
我国口腔科材料的分类情况
目前我国现行有效的口腔科材料分类目录为2002 版医疗器械分类子目录6863 口腔科材料[1],及2002 年后至今,国家食药监局陆续发布的一系列分类界定文件[2]。我国口腔科材料产品的管理类别基本遵循《医疗器械分类规则》的附表中所规定的方法进行界定[3],即根据医疗器械的预期目的,通过使用形式、使用状态、是否接触人体及接触时间界定产品的分类,如复合树脂等充填材料,预期用于龋损牙的充填修复,符合植入器械定义,使用状态为创伤/组织+ 长期使用,因此界定为Ⅲ类。
不过值得注意的是,预期用于治疗牙体牙髓病变的材料,即用于牙齿中的材料,如根管充填材料、垫底和洞衬材料、复合树脂、水门汀、粘接材料、桩核材料、根管桩等,以及用于预备好的牙齿上的材料,如冠、桥材料、粘接剂、粘固材料等,由于其预期目的符合植入器械定义,并且为长期使用,在我国这些产品的管理类别等同于植入器械或手术侵入器械而被界定为高风险的Ⅲ类,但在欧盟、美国、日本、加拿大等国,依据其对应的分类规则,这些产品均被视为具有较低风险,为低风险的I 类或II 类材料。
2.
国外口腔科材料分类管理情况
(1)美国FDA
美国FDA 按风险不同由低到高分为1、2、3 三个管理类别。
美国FDA 没有分类规则,对医疗器械的分类是基于数据库的方式并不断更新,基本上是针对具体产品确定其管理类别,截止2016 年5 月19 号,有关口腔医疗器械共306 个[4]。其分类遵循风险的原则,如义齿粘附剂(或义齿稳固剂),该产品在使用过程中处于一种溶胀状态,并与口腔粘膜组织大面积接触,因此其组成中的某些成分极有可能被溶出,并能被粘膜吸收,也易受口腔组织液或外来物质影响而产生有害物质,因而其生物学危害性风险较高。这类产品按定义上讲属于“非手术干预、通过自然腔道、且预期不与有源器械连接,但容易被粘膜吸收”的产品,应对应于较高风险的管理类别,但美国FDA 关于义齿粘附剂对应于不同的基质材料有13 个产品分类,其中有8 个1类,5 个3 类,这就是基于风险分析的原则,当材料组成能证明其生物学危害较小时界定为1 类,若含有可能导致生物学危害的物质或不明确时界定为3 类。
美国FDA 有关口腔医疗器械中只有14 个3 类器械(其中义齿稳固剂就有5 个,非口腔材料类2 个)。其中真正涉及材料的只有9 个(义齿稳固剂按1 个计算),具体为:义齿粘附剂、含氯仿根管充填材料、颞下颌关节植入体、肩胛盂假体、关节盘假体、下颌髁状突修复体、含生物学成分的骨修复材料、含生物学成分的口腔材料。
从以上分析可以看出,美国FDA 对口腔材料的分类与IMDRF(GHTF)的分类规则基本一致,高风险产品为植入产品或含有生物学成分或药物成分的产品,尤其是义齿粘附剂的管理类别的界定可以明显看出其管理类别界定的风险评估的原则。
(2)IMDRF(GHTF)
IMGRF(GHFT)为国际医疗器械监管机构论坛,该组织成员有美国、欧盟、加拿大、日本、中国、俄罗斯、巴西等国家政府药监组织及世界卫生组织(WHO)。该组织按风险由低到高将医疗器械分为A、B、C、D 四种管理类别,A、B 为低风险,C、D 为较高和高风险产品。
IMDRF(GHTF):该组织关于口腔科材料的管理类别见2012 年版分类规则文件[5],该文件中的规则5、规则6、规则7、规则8 涵盖了口腔科材料的管理类别IMDRF(GHTF)不涉及具体产品的分类。目前欧盟、加拿大、日本、新加坡等国家基本上采用GHTF 的分类规则[6]。在GHTF的分类规则文件中,口腔科器械均作为特别项进行说明,一般与项下的管理类别相同或比项下的其他产品低1 个管理类别,具体如下(摘译并文字性编辑或说明,具体产品可参见表1):
规则5 :所有通过非手术进入人体腔道的侵入器械,且不与有源器械联接,如短期使用为B 类,但在口腔时,是在A 类;如长期使用是在C 类,但若长期用于口腔中,并且不容易被粘膜吸收,是在B 类;
规则6:所有通过手术侵入、短暂使用的器械是在B 类;
规则7 :所有外科手术侵入器械,短期使用时在B 类,除非它们预期在体内发生化学变化(如器械用在牙齿上除外),在这种情况下,它们是在C 类;
规则8 :植入器械及长期外科手术侵入器械为C 类,但预期用于牙齿中(本文作者注:指垫底、洞衬、根管充填材料、复合树脂等)或预备好的牙齿上(本文作者注:冠、桥类材料)的器械则为B 类;含药、具有生物学作用或可吸收、在体内发生化学变化(用于牙齿的器械除外)为D 类。
(3)欧盟
欧盟的分类规则基本同IMDRF(GHTF)。由低到高分为I、IIA、IIB、III 四种管理类别,其中I 和IIA 类为低风险产品,IIB 和III 类这较高和高风险产品。
欧盟文件确定的分类规则[7],涉及口腔科材料见于第1、5、6、7、8、13、15 条分类规则,其中第1 条和第15条只各涉及1 个产品,分别是“正畸材料和器具,口外用”和“具消毒功能的义齿清洁剂”。
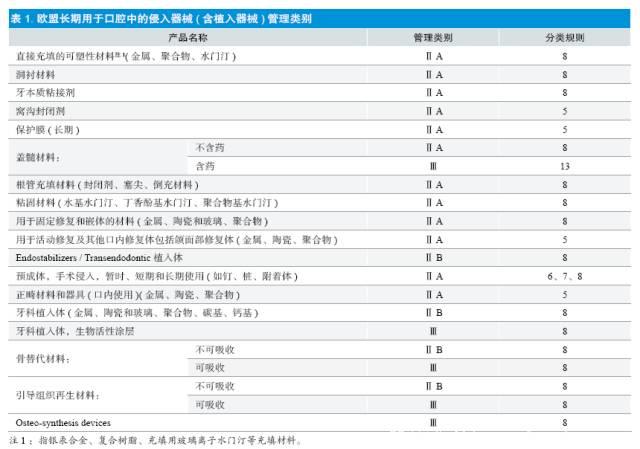
鉴于口腔科产品的多样性,欧盟专门发布了技术报告[8],其中长期用于口腔中的手术侵入器械(含植入器械)及其对应的管理类别见下表:
(4)日本
日本采用了类似GHTF 的分类规则并制订了JMDN数据库[9],具体列明了产品名称、定义、管理类别等信息,并有与GHTF 规则的比较及新旧版本的对比。日本医疗器械数据库中将植入材料、骨填充及修复材料和正畸用的种植支抗等列入矫形器械、其他口腔科材料则列入齿1- 齿9,共包含约303 条产品信息。根据其具体内容分析,每一类材料应包含主体材料及其他相关材料,如印模材料中包括牙龈线,义齿基托材料中包括软衬材料、义齿粘附材料,牙冠材料中包括漂白材料等,石膏及石膏制品中除石膏外还包含有各种包埋材料。
日本医疗器械产品的风险由低到高分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四种管理类别,口腔科材料中高风险的Ⅲ类和Ⅳ产品简述如下:
矫形器械- 牙科材料:共22 个,Ⅲ类产品11 个(种植体和不可吸收的骨重建材料),Ⅳ类1 个(可吸收骨重建材料)。
齿01 :牙科用金属,共44 个,无Ⅲ类及以上产品。
齿02 :牙冠用材料,共29 个,其中Ⅲ类产品1 个,指治疗或美白牙齿材料。
齿03 :义齿基托材料,共23 个,无Ⅲ类及以上产品。
齿04:牙科用根管充填材料,共8 个,Ⅲ类产品有3 个,其中1 个含药永久根管充填材料,1 个含氢氧化钙,1 个含碘仿。
齿05 :粘接、充填及暂封材料,共115 个,Ⅲ类产品最多,其中有37 个Ⅲ类产品,但均属于含药器械9。
齿06 :牙科印模材料,共23 个,其中Ⅲ类产品2 个,1 个是含药的排龈线,1 个是含药的排龈膏类。
齿07 :牙科用蜡,共14 个,全部为I 类。
齿08 :牙科用石膏和石膏制品,共8 个,全部为I 类。
齿09 :牙科用研磨材料,共17 个,其中Ⅲ类产品1 个,为含药的牙齿清洁和抛光材料。
3.
我国与国外同类产品管理类别比较分析
综上所述,我国目前现行的口腔科材料的管理类别中高风险产品,即Ⅲ类产品的数量要明显高于国外同类产品,并且这些产品基本上集中在预期用于治疗牙体牙髓病变所用的材料上,即用于牙齿中或预备好的牙齿上的各种材料。预期用于牙齿中材料是指垫底、洞衬、根管充填材料、复合树脂、粘接剂等,预期用于预备好的牙齿上是指冠、桥类材料、粘固材料等。
出现这一现象的原因在于根据其预期用途、使用形式、使用状态、是否接触人体及接触时间的分类规则,这些产品的分类均等同于植入器械或长期手术侵入器械,因而应归于高风险的管理类别。但FDA、GHTF、欧盟、日本等在分类时则基于风险的原因均将口腔科医疗器械单独列出进行分类,明确这些产品要低于相同项下的植入和长期侵入器械的管理类别1 个等级,而我国在《医疗器械分类规则》中不存在类似的说明,因而导致我国同类产品的分类普通高于国外同类产品。
事实上,在牙体上使用的材料有其鲜明的特点,风险程度较低。其一,在牙齿上使用的材料基本上不与人体其他组织直接接触,这类材料对人体产生危害的途径主要是通过口腔粘膜组织或通过胃肠道吸收而对人体产生副作用,从药物代谢角度讲,这是一种最有可能避免危害发生的方式;其二,由于这类材料是替代缺损或缺失牙齿的功能,要求必须有最小的降解或物质释放,因而产生的生物学危害的有害物质也将极为有限;其三,由于牙体牙髓病变不同于其他疾病(指疾病的治疗需要进行手术侵入或植入医疗器械),它是一种极为常见的疾病,临床病例数每年至少以亿计,并且对各种不同人群几乎没有什么限制,因此对于常规口腔器械,若其安全、有效性存在某种程度上的争议,将会在临床中很快得到验证和确认,若存在替代产品,那么在安全性和有效性方面存在缺陷的产品将会很快被淘汰;其四,目前常规口腔材料在口腔临床中使用历史相当长,机理明确,且无严重不良事件发生,其临床使用安全性得到了充分的验证,如氧化锌丁香酚水门汀和磷酸锌锌水门汀近百年的历史,聚羧酸锌水门汀有50 余年的历史,常规水门汀中最新产品玻璃离子水门汀也有四十的历史,复合树脂有60 余年的历史,牙胶尖有近百年的历史。
有鉴于此,考虑其可能的风险和生物学危害及国外同类产品所界定的管理类别,这些用于治疗牙体牙髓病变的产品管理类别是按照植入器械或侵入器械的分类规则进行界定,还是按照《医疗器械监督管理条例》中“按照风险程度进行分类管理“的总原则进行界定应引起监管部门和分类目录制订者特别的关注和重视。
4.
小结
综上所述,我们认为对于口腔科材料管理类别的判定,应充分考虑其临床应用特点,依据风险分析的原则进行界定,并能借鉴国外分类规则和分类现状,否则如果将常规低风险产品划分为Ⅲ类产品,这将会影响我国牙科行业的可持续、健康的发展,使我国目前严重落后于世界先进水平的口腔材料行业在今后相当长的时间内都不会得到改善或进步,并且将使政府的管理成本、企业的经营成本增加,导致社会资源不必要的浪费。
本文刊登于《中国医疗器械信息》杂志2016年6月(下半月刊)1-4页
作者: 刘彦安
单位: 湖北省食品药品监督管理局技术审评核查中心 (湖北 武汉 430079)
医疗器械创新网
微信号:innoMD
分享行业创新资讯、提供专业服务
【声明】本文为转载,医疗器械创新网不对其准确性及观点负责。如涉及版权问题请联系0512-85667873,我们将立即处理,以保障双方权益,谢谢。