出品:科普中国
制作:外密子
监制:中国科学院计算机网络信息中心
2013年,好莱坞影星安吉丽娜·朱莉在接受基因检测后,切除了乳腺。这一夺人眼球的新闻让不少人第一次知道了“基因检测”。
现在,民众对自己的健康状况愈发关注,与此同时,基因检测的价格越来越亲民。不少人进行基因检测,想要了解自己的健康状况,想要预知重大恶性疾病的可能性。而一旦出现“患某癌风险高”这种检测结果,就会让人忧心忡忡,焦虑不已。
那么,基因检测的结果值得相信吗?有必要为了健康进行基因检测吗?
要回答这些问题,我们就得从个性化医疗说起。
个性化医疗是怎么产生的
虽然近几十年来临床医学飞速发展,人均寿命也大幅度提升,可针对败血症,超急性移植器官排斥和心肌梗塞之类的致命急性病,和糖尿病,白血病,恶性肿瘤这些相对慢性但可能致命的疾病,传统的诊断和治疗方法并不都尽如人意。
急性疾病,例如败血症,常常需要监测血清中某些蛋白类标记物(如白介素-6)的浓度以跟踪病情的发展,而使用传统方法,常需要数小时乃至一天的检测时间。慢性疾病,例如中晚期癌症,普适性的手术与化疗往往无法取得令人满意的疗效。
这些现实风险让大家在死神的面前很没有自信。
基于此类风险,针对不同身体状况的患者进行个性化诊疗方案设计的产业也就应运而生了,这就是个性化医疗。
近几年,个性化医疗服务的兴起,似乎为民众打开了一个完全不同的“医疗新世界”。
作为一名业内研究人员,我想我们有必要让民众了解个性化医疗的发展现状,哪些个性化医疗的手段对于疾病治疗非常有帮助,又有哪些个性化医疗的手段其实还不成熟,而市场上还有哪些所谓的“个性化医疗”服务,根本就是假的。
个性化医疗都包括什么
个性化医疗主要发展出了两个方向,分别是即时诊断(Point-of-care Diagnostic)和精准医疗(Precision Medicine)。
即时诊断主要针对的是病情发展较为迅速的急性病或需要实时获取测量数据的疾病(如糖尿病)。这一类技术的主要检测对象是小分子或蛋白类生物标记物的浓度。现在市场上常见的血糖试纸就是一个成功的即时诊断产品。
但很可惜,针对血清中蛋白类生物标记物的即时诊断技术还未有成熟的市场化产品,而这正是急性病(如器官移植后的急性排斥和急性心肌梗塞)的病程监测中所必需的。
近些年来,微流控技术和生物微流传感器技术飞速发展。受益于微流反应器的小体积和高表面积体积比,在这类反应器内进行免疫吸附反应的效率,相比传统反应器有了大幅度的提高。
从结果上看,与传统方法相比,检测蛋白类生物标记物所需的血样量大幅度减少,检测时间也大幅度缩短。
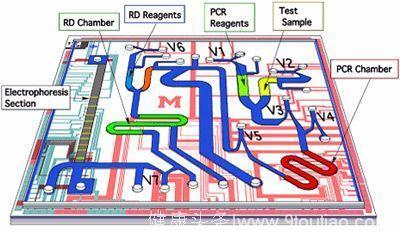
图 一个用于扩增并检测DNA的微流芯片
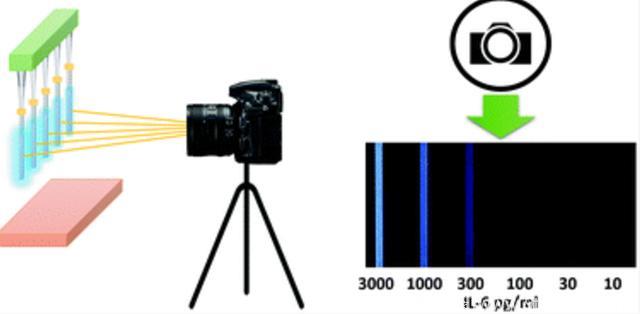
图 一个用于检测血清中蛋白标记物浓度的生物传感器示意图
截至2017年上半年,比较优秀的生物微流传感器可以在小于半小时的时间内用小于10微升的血样检测出单个或数个(小于10个)蛋白标记物的血液浓度(量程和敏感性各不相同)。但由于微流控芯片的集成度非常高,大部分产品的结构设计和流体控制系统还不够完善,这导致很大一部分技术的可靠性都还不足以被用于这些“生死只在一线之间”的急性病的临床诊断。
至于大家最为关心的恶性肿瘤,这类慢性病虽然起病不像心肌梗塞那样凶险,但为了进行更有针对性的治疗,提高患者的生存期,在治疗开始前进行准确的诊断也是必不可少的环节。
精准医疗,就是把基础打在了癌症的精确诊断上。
传统的肿瘤分型一般停留在组织切片上细胞形态的层面上。而精准医疗的目光则对准了肿瘤所包含的遗传信息。这些信息包括了癌细胞内和细胞代谢产物(包括细胞碎屑,外泌体,分泌出的蛋白)里的DNA, mRNA, siRNA, 和特异性抗原蛋白。
如何进行精准的肿瘤诊断
单就诊断的层面上讲,针对细胞抗原蛋白的检测技术,和针对单致病基因的突变检测技术已经比较成熟也比较可靠,它们和疾病治疗之间的关联也比较明确。
其中,实体瘤的抗原表达检测一般采用组织切片免疫荧光法 (Immunofluorescence),白血病这类游离在血液中的肿瘤细胞抗原表达检测一般采用荧光流式细胞术(Flow Cytometry),单基因突变检测一般采用荧光定量PCR法。
如果这些测试的结果显示肿瘤拥有某些特定基因型的标记物,医生可以选择使用针对性比一般化疗药物更强的单克隆抗体药物 (辅助免疫系统和化疗药物识别肿瘤细胞)。
比如,治疗结肠癌的西妥昔单抗,就是一种针对野生型(Wild Type)表皮生长因子受体(EGFR)的单克隆抗体药物。对于白血病这样游离在血液中的“肿瘤”,如果检测结果表明它属于CD19阳性的B细胞白血病亚型,还能使用疗效比较好的CAR-T 细胞免疫疗法,就是让受过特殊处理的T淋巴细胞去识别异常增殖的B细胞(针对实体瘤的细胞免疫疗法还在发展中)。
一些单克隆抗体药物
与肿瘤细胞抗原蛋白检测技术相比,肿瘤组织RNA检测、外泌体(Exosome)抗原检测、外周血肿瘤细胞(CTC)和肿瘤DNA (ctDNA)检测,从理论上能提供比蛋白抗原检测更多的遗传信息,在癌症的早期诊断上也都有重要的提示价值。但由于这些技术的实现手段和医学价值还都处于学术研究讨论的阶段,即便有患者进行了针对它们的检测,结果也只有有限的个人参考价值而没有确切的临床指导意义。
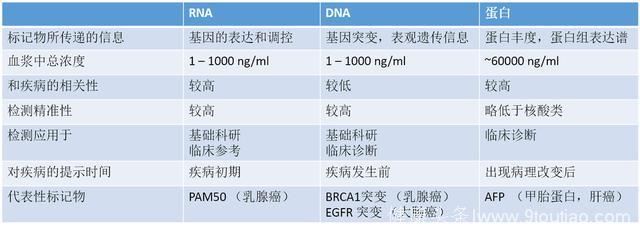
图 不同类型的生物标记物和它们的功效
个性化医疗领域不乏鱼目混珠的“李鬼”
俗话说,林子大了什么鸟都有。个性化医疗的盘子大了,也出现了不少鱼目混珠的技术和公司。
前几年,个性化医疗领域有一个非常著名的“神话”,说的是一个女科学家兼企业家伊丽莎白.霍尔姆斯(Elizabeth Holmes)和她旗下的Theranos公司,发明了一种基于微流生物检测技术的芯片,可以用指尖血轻而易举得检测二百个生物标记物的浓度,能同时检测多种癌症和急慢性疾病。
一时间,霍尔姆斯和她的公司名声大噪,市值估价一度达到了90亿美金。
然而,这项技术从一开始就争议不断。其实业内人士大多知道,通过收集指尖血一般也就能采集几十微升的血液样本,用这么小的样本量(血清体积还只是血液体积的一半),即便采用最先进的微流芯片技术,同时检测数个蛋白标记物的浓度已属不易,像霍尔姆斯所说的那样同时检测几百个标记物则更像是天方夜谭。难道那么多同领域的科研人员都成了饭桶?
事实很快就证实了大家的疑虑, 2015年十月,Theranos公司被爆出实验数据大量造假。随后,在极短的时间内,这个产业神话就土崩瓦解了。
 图 伊丽莎白·霍尔姆斯
图 伊丽莎白·霍尔姆斯
除了霍尔姆斯这种“光明正大”的诈骗之外,还有不少打着“精准医疗”,“新医疗技术”旗号的“准诈骗”。
例如DC-CIK细胞免疫疗法,它本身并不是一个完全的骗局 (当然其临床有效率确实十分堪忧,且一般起效也是在白血病患者身上),只是现在提供这类服务的医院,大多在进行非常夸张的过度宣传。魏则西当时所遭遇到的,就是这种情况。他所患有的滑膜肉瘤根本无法被这种方法治愈,而那些无良医院和广告公司却把它宣传成了救命的良方。
未来疾病预测还没有那么神奇
2010年以来,随着全序列DNA测序成本的不断降低,“疾病预测”,作为另一种类型的“精准医疗”服务,也逐渐呈现在了普通民众的眼前。
未来疾病预测,基于的是这些年来同样蓬勃发展的全基因组关联分析(Genome-wide association study,GWAS)。
从原理上讲,如果对一个个体的基因组进行测序,可以通过比对他的DNA序列与常人的差异,找出这个个体的突变基因或潜在致病基因,从而达到预测还未出现任何症状的疾病的目的。
2005年以来,科学家先后找出了与冠心病、2型糖尿病、乳腺癌、克罗恩病等疾病相关的几个基因。由于美国奥巴马政府的大力支持,未来疾病预测相关产业这几年在美国飞速发展,在国内同样也有多个精准医疗服务商开始经营相关业务。不少服务商甚至声称可以检测几十种潜在恶性疾病。
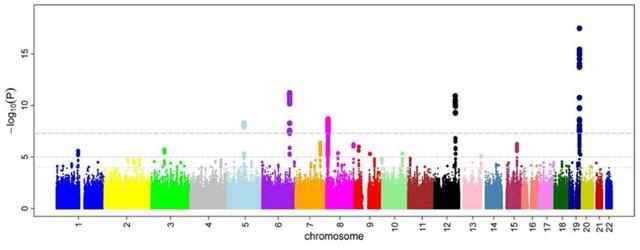
图 GWAS检测结果图(曼哈顿图),纵坐标代表了患病风险
然而,现实却比医疗服务商的宣传和大家的期望要骨感得多。
最新的结果表明,器官的功能或者疾病的产生和发展过程远不是一个或几个基因就能完全调控的。疾病的进程受后天环境的影响,远比受先天基因的影响要明显。牛津大学的McCarthy教授最近进行的一个有数百万人参与的研究表明,2型糖尿病与基因变化之间的联系远不如之前GWAS研究推测得那样明确。这就是说,除了少数几个已被验证有高度相关性的基因,通过进行GWAS分析预测未来会出现的疾病,得出的结果也许并不怎么可信。换句话说,这几年炒得火热的全基因组测序,可能只比算生辰八字和看面相这类的算命法科学一点。
“打开”个性化医疗的正确方式
作为一个新生事物,个性化医疗应该被大众用更加理性的眼光对待。
即时诊疗,肿瘤表型分析这类的新技术,作为一种辅助治疗的手段,对提高治疗的时效性和针对性是功不可没的。患病后进行这类有效性已被验证的检测也是应该被大力提倡的。
至于前文提到的全基因组GWAS检测和类似的外泌体,RNA检测,如果家有余财,大家可以去试一试,给未来的自己敲个警钟,但大可不必在还没见到任何疾病的症状时就进行激进的手术,也不需要用神乎其神的检测结果来吓唬自己。
毕竟,有一个健康的心态和生活方式,才是预防疾病的根本。

“科普中国”是中国科协携同社会各方利用信息化手段开展科学传播的科学权威品牌。
本文由科普中国融合创作出品,转载请注明出处。