据估计,人体大约含有数以万亿计的微生物,大约相当于体重的1-3%,称为人体共生微生物。与健康研究的其它领域相比,人体共生微生物的研究,特别是肠道微生物的研究在过去的很长时间内并没有引起足够的重视,因此,肠道菌群也被称为是“被遗忘的器官”。直到20世纪90年代末期,科学家开始关注肠道细菌对免疫功能的影响。此后,研究人员发现了肠道细菌与许多疾病之间的关联,包括肥胖、糖尿病、关节炎、多发性硬化症和癌症等等。
越来越多的研究表明肠道细菌也可以影响一个人的心理状态,如情绪、焦虑水平等等。有研究表明,肠道中某些特定细菌的异常增加与抑郁症有关,而有些细菌可以帮助我们维持好心情。因此,研究人员开始关注是否可以通过补充一种或多种有益微生物来改善抑郁和焦虑症状,同时改善整体健康。
很多研究揭示了益生菌在改善抑郁和焦虑中的作用,前面我们介绍了科学实验证明的能够帮助改善抑郁和焦虑的益生菌或益生元:
扒一扒那些可能改善情绪的益生菌(一)
扒一扒那些可能改善情绪的益生菌(二)
扒一扒那些可能改善情绪的益生菌(三)
扒一扒那些可能改善情绪的益生菌(四)
扒一扒那些可能改善情绪的益生菌(五)
很多人并不知道补充益生菌或者获得健康的肠道菌群是如何改善情绪和减少焦虑的。在最近几年里,越来越多的研究证明肠道可以通过多种途径给大脑发送信号。研究人员使用用肠-脑轴(Gut-Brain-Axis)来更精确地描述肠道和大脑之间的这种沟通和联系。
请记住,肠道和大脑之间的沟通和联系是双向的,也就是说大脑会影响肠道,同样肠道也会影响大脑。这意味着,如果你受到了心理压力,那么你的大脑可能会改变肠道内的细菌组成。另一方面,清除肠道内的健康菌群(比如,大量服用抗生素)可能会显著地改变大脑内的神经生化过程,进而改变你的情绪。
那么,肠道细菌(比如,益生菌)究竟如何影响大脑功能呢。当肠道菌群发生改变时,它会调节肠道神经系统的活性。肠道神经系统是一个包含超过5亿个神经元的复杂外周神经网络,也经常被称为”第二大脑”。肠道细菌也会影响自主神经系统的两个分支,即交感神经和副交感神经。
1、肠道神经系统:肠道神经系统是由传入神经元、传出神经元和神经胶质细胞构成。人体肠道内的微生物将信号传递给这些外周神经元,进而对大脑功能产生影响。当一个人的肠道菌群状态不太理想或者完全缺失(比如无菌小鼠的研究),肠道神经系统就会明显异常,神经节会更少,神经纤维会更薄。

外周神经递质:肠道会产生很多的神经递质,这些神经递质的产生有时会依赖与肠道内的某些特定的微生物。研究显示,肠道细菌可以产生乙酰胆碱、γ-氨基丁酸、组胺、去甲肾上腺素和5-羟色胺。比如,一些乳酸杆菌能够把谷氨酸(兴奋型神经递质)转化为γ-氨基丁酸(抑制型神经递质)。这些外周的神经递质刺激肠道内的受体,影响情绪。研究者甚至提出假设,这些神经递质也可能会穿过血脑屏障作用于大脑,最终影响神经活动。
外周受体:你肠道内的细菌不仅仅可以刺激产生外周神经递质,而且它们也会改变递质受体的水平。在啮齿类动物的研究中已经证实受体的调节可能在慢性疼痛中发挥重要作用。一项在动物模型中的实验证明补充益生菌可以增加大麻素受体和阿片样受体的水平。
中枢神经递质:一些肠道细菌可以直接改变大脑内的神经递质及其受体的水平。一项研究发现,给动物补充鼠李糖乳杆菌显著改变了大脑内的整个γ-氨基丁酸系统,最终降低了动物的焦虑和抑郁水平。但是目前还不清楚中枢内的神经递质是如何发生改变的。
人体是个有机的整体,无论如何我们都无法绕开一个事实,那就是肠道神经系统的活动也会调节中枢神经系统的信号传导。研究人员强调外周肠道神经系统的神经元能够影响迷走神经,尤其是给中枢神经系统传送信号的迷走传入神经。这个结果提示我们肠道神经系统确实可以影响大脑的功能。
2、迷走神经:大多数的研究证据表明肠道菌群对大脑活动的影响主要是通过迷走传入神经。这些迷走神经将收到的知觉信号传入中枢神经系统。小鼠的研究证明,当迷走神经通过手术切除后,健康的肠道细菌也不能减少焦虑、缓解压力和/或改善情绪。
脑血流量:人们普遍认为迷走神经能够影响脑血流量。脑血流量的改变,特别是某些特定的脑区,可以影响一个人的心理状态和对某些行为的偏好。在一些抑郁症患者中,迷走神经刺激减少了脑内一些特定区域的血流量(比如眼窝前额皮层),而增加另外一些区域的血流量(比如内侧核)。因为肠道细菌调节迷走神经向大脑的信号传递,毫无疑问,它们也可能影响某些脑区的血流量。
神经传导:迷走神经刺激也可能会改变大脑内的神经传递,但是,神经递质的影响可能是对来自肠道菌群的信号的直接反应。一些研究发现迷走神经刺激和乙酰胆碱改变之间的关性,但是现在仍然不清楚大脑内是否会发生同样的变化。肠道细菌诱导的迷走神经信号改变可能影响突触间隙的神经递质水平,进而影响神经信号。
神经电活动:肠道菌群引起的迷走神经信号的改变可能也会改变大脑内的神经电活动。换而言之,补充益生菌可能会改变脑电波。这些脑波的改变一部分是伴随着大脑局部活动的变化和神经传导的改变而出现的。神经电活动的改变可能是肠道菌群相关的神经调节的重要组成部分。
大脑局部激活:研究已经证明补充发酵食物和益生菌数周可以改变大脑局部区域的活性。换句话说,一些脑区的活性变得更高或者更低(比如:下丘脑-垂体-肾上腺素轴)可能是肠道菌群直接作用的结果。精确的神经激活和失活究竟跟哪些特定的益生菌菌株相关联仍然不是完全清楚。然而,肠道菌群对布局脑区活性的影响可能是通过迷走神经的调节来实现的。
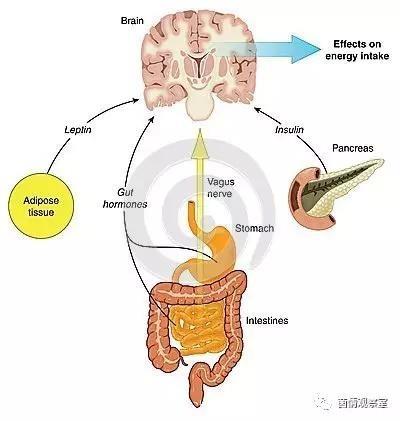
迷走神经功能正常的小鼠在补充益生菌后可表现出显著的焦虑减少和情绪改善。迷走神经功能紊乱与许多精神疾病和总体健康状况相关,从抑郁到肥胖。事实上,通过迷走神经刺激可以显著改善某些患者的情绪,减少肥胖。
很明显,一个人的肠道菌群会增强或减弱迷走神经的激活速率。迷走神经的这种改变可能使大脑中的某些神经通路激活或失活,调节神经传导。尽管肠道菌群还可通过许多其它方式影响大脑功能,但是迷走神经张力的调节是最重要的途径。
益生菌改善焦虑和抑郁的其它方式……
益生菌还可以通过许多其它途径来改善抑郁和焦虑的症状。补充合适的益生菌可以降低炎症、减少P物质的产生、向大脑内传递神经递质、改变激素水平和降低下丘脑-垂体-肾上腺素轴的活性。此外,在有过多病原体存在的情况下,益生菌可以帮助修复肠道屏障,改善营养吸收,从而发挥对健康的有益作用。
抗炎症:患有抑郁、焦虑或压力过大的人往往都同时伴有炎症。一些专家指出,长期低水平的炎症状态参与许多神经精神疾病的发生。有趣的是,一些研究强调服用抗炎药物可能是个不错抑郁治疗方法。在许多病例中,在肠道病原菌存在的情况下,炎症很难以消除甚至还会加重。炎症也会促进P物质的产生,这是一种与抑郁相关的神经递质。益生菌可以抑制病原菌,降低炎症,减少P物质水平,最终改善情绪。
抗氧化作用:有证据表明,补充益生菌可以通过清除自由基和抑制活性氧的产生而起到抗氧化的作用。抑郁症和焦虑症患者往往会表现出较高的氧化应激,这会诱发神经炎症,导致中枢神经系统的异常。补充合适的益生菌可以降低活性氧的产生,改善神经功能和一个人的神经精神状态。
产生神经递质:有的益生菌可以直接调节大脑功能,能够对精神疾病患者产生健康效应,因此也被科学家称为“psychobiotics”,在前面我们将其翻译为益心菌(参阅:益心菌:你的肠道细菌和你的心情)。他们参与调节大脑活动的途径之一就是通过产生或者向中枢神经系统传递神经递质。我们已经知道,肠道菌群可以在外周神经系统中产生神经递质。它们也有可能将产生的γ-氨基丁酸和5-羟色胺传递至大脑。虽然益生菌对大脑的作用是间接地,比如通过迷走神经、脊髓和/或神经内分泌系统,它们似乎也可以改变中枢神经系统的神经传导。
改变激素分泌:肠道菌群不仅仅影响肠道神经系统,也会影响整个自主神经系统,包括交感神经和副交感神经。肠道菌群也可能会通过自主神经张力来改变身体内的激素分泌。过度活跃的交感神经系统与下丘脑-垂体-肾上腺轴的刺激相关,刺激下丘脑-垂体-肾上腺轴会促进促肾上腺皮质激素释放因子和促肾上腺皮质激素的释放,这两者的释放会最终促进糖皮质激素的释放。所以,当一个人在压力、焦虑或者抑郁状态下,其体内通常会有较高的皮质醇水平。益生菌可以降低下丘脑-垂体-肾上腺轴的活性,抑制应激激素的释放,从而起到放松心情和改善情绪的作用。
恢复肠道屏障:一些焦虑和/或抑郁的个体可能会出现肠漏症状。肠漏是以肠黏膜的损坏,肠道通透性增加为主要特征,肠道通透性增加会使得一些毒素容易从肠道进入血液,从而诱发自主免疫、神经炎症甚至造成神经毒性。补充益生菌可以恢复肠道紧密连接的完整性,修复肠漏。通过简单的修复肠漏就可能对心理健康和整体健康状态具有非常重要的治疗意义。

抑制单胺氧化酶:抑制单胺氧化酶:单胺氧化酶主要参与清除突触之间的神经递质。抑制单胺氧化酶的活性通常能够有效地改善焦虑和抑郁患者的症状。单胺氧化酶的抑制使得神经递质能够在突触间隙中停留较长的时间,从而促进神经交流。一些研究发现,某些益生菌菌株(比如:动物双歧杆菌)能够抑制单胺氧化酶的活性。假设它们能够抑制单胺氧化酶的活性达到适宜的水平,那么认为益生菌能够改善情绪也是合乎逻辑的。可能在未来我们可以找到一些益生菌菌株能够足以抑制单胺氧化酶的活性从而在临床上治疗抑郁。
抑制神经毒性:那些肠道粘膜内布满病原菌的人或许不会知道,这些细菌也会影响他们的认知功能和情绪。当肠道内的病原菌数量超过有益菌的数量时,他们可能会产生一些代谢物,比如D-乳酸和氨。如果你正在和抑郁、思维混乱和过度焦虑作斗争,那么你的肠道很可能正产生一些毒素作用于你的大脑。这些神经毒素通过杀死脑细胞和诱导神经炎症状态与神经化学紊乱而对大脑造成损伤。这样神经元之间的信号传递更难,神经递质的水平可能被改变,线粒体功能也可能出现紊乱。给肠道补充好的细菌,可能会有助于杀死坏的细菌,阻止粪肠球菌和血链球菌等造成D-乳酸的积累。
营养吸收:如果肠道不健康或者肠漏,那么我们就不能从食物中获得足够的营养。营养吸收缺乏也会影响情绪和认知功能。即使你吃进去的食物营养均衡,但是你不能充分的吸收他们,那么营养的缺失也会最终影响到你的焦虑和抑郁的严重程度。补充益生菌能够恢复肠道内的健康菌群,帮助修复肠道,改善吸收,那么也有可能降低焦虑和抑郁。
减少病原菌:补充益生菌被证明可以通过减少病原菌的数量来改善身体健康。许多好细菌可与肠道中的病原菌竞争。经常补充益生菌可以抑制病原菌的生长,比如艰难梭状芽孢杆菌。因为这些病原菌可对大脑功能产生不利的影响,补充益生菌可以显著改善我们的心理健康。例如,研究表明病原菌会影响海马神经发生,改变下丘脑基因表达,影响突触可塑性,而促进应激反应。健康的肠道菌群可以减弱病原体诱导的这些有害的神经改变。
P物质减少:P物质是广泛分布于神经纤维内的一种神经肽。那些具有明显炎症的人往往有较高水平的P物质。此外,研究表明抑郁症患者的P物质产生也明显升高。相比之下,那些没有抑郁症状的人P物质浓度往往较低。缺乏健康的肠道细菌也与P物质水平高直接相关,抗生素处理的动物表现出P物质水平的升高。幸运的是,补充益生菌可以降低P物质的水平,这可能是通过降低炎症来实现的。不管怎样,这可能也是益生菌改善情绪的一种机制。
参考文献:
Wall, R., et al. (2014). "Bacterial neuroactive compounds produced by psychobiotics." Adv Exp Med Biol 817: 221-239.
Perez-Burgos, A., et al. (2013). "Psychoactive bacteria Lactobacillus rhamnosus (JB-1) elicits rapid frequency facilitation in vagal afferents." American Journal of Physiology-Gastrointestinal and Liver Physiology 304(2): G211-G220.
Dinan, T. G., et al. (2013). "Psychobiotics: A Novel Class of Psychotropic." Biological Psychiatry 74(10): 720-726.
Conway, C. R., et al. (2012). "Brain blood-flow change with acute vagus nerve stimulation in treatment-refractory major depressive disorder." Brain Stimulation 5(2): 163-171.
Zhou, L. H. and J. A. Foster (2015). "Psychobiotics and the gut-brain axis: in the pursuit of happiness." Neuropsychiatric Disease and Treatment 11: 715-723.
Hemarajata, P. and J. Versalovic (2013). "Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation." Therapeutic Advances in Gastroenterology 6(1): 39-51.
Wasilewski, A., et al. (2015). "Beneficial Effects of Probiotics, Prebiotics, Synbiotics, and Psychobiotics in Inflammatory Bowel Disease." Inflammatory Bowel Diseases 21(7): 1674-1682.
Ramiah, K., et al. (2008). "Surface-bound proteins of Lactobacillus plantarum 423 that contribute to adhesion of Caco-2 cells and their role in competitive exclusion and displacement of Clostridium sporogenes and Enterococcus faecalisw." Research in Microbiology 159(6): 470-475.












