急性白血病是一种造血干细胞的恶性克隆性疾病。这种疾病多发于儿童和青少年人群,目前,白血病的低龄化仍在持续。但就在昨天,美国食品药物管理局(FDA)开启了医学领域的新纪元。这项难以治愈的恶性病,或将正式列入可治愈范围。
据《纽约时报》7月12日报道,FDA肿瘤药物专家咨询委员会(ODAC)以10:0的投票结果一致支持批准治疗白血病的CAR-T基因疗法Tisagenlecleucel (CTL-019)上市。该疗法主要运用于治疗3-25岁复发或难治性急性淋巴细胞白血病(ALL)患者,由宾夕法尼亚大学和诺华公司(Novartis Corp)合作研发。
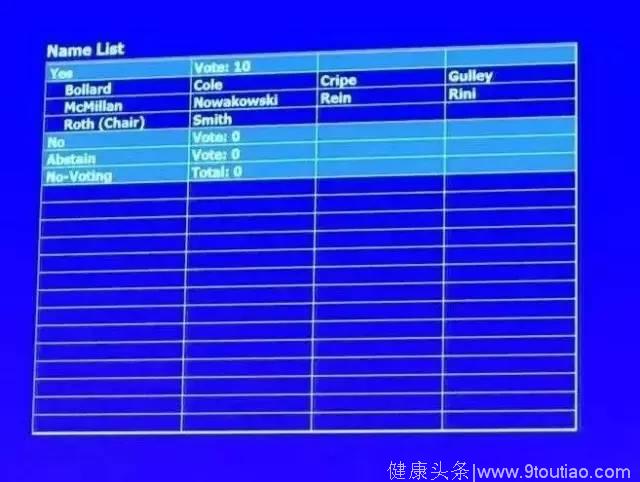
现场投票结果。图据医药魔方
根据CBS新闻报道,FDA预计将于今年10月3日做出最终批准决定。尽管没有规定FDA在最终批准时必须遵从专家委员会意见,但根据美国各大媒体报道,专家委员会的一致通过意味着该疗法可在今年获得FDA批准。这意味着CTL-019将极其有可能成为美国甚至全球历史上首个获批上市的CAR-T基因疗法。
解读
什么是CAR-T基因治疗法?
CAR-T是细胞免疫治疗的一种,也是目前世界上最先进的细胞免疫疗法。
简单说,CAR-T细胞治疗恶性肿瘤的方法是,先从患者体内分离提取出T细胞,再通过基因改造技术,人工改造T细胞,在体外大量培养后生成肿瘤特异性CAR-T细胞,再将其回输患者体内用以杀死癌细胞。这种疗法具有精准靶向、杀伤性和活跃性持久的特点。
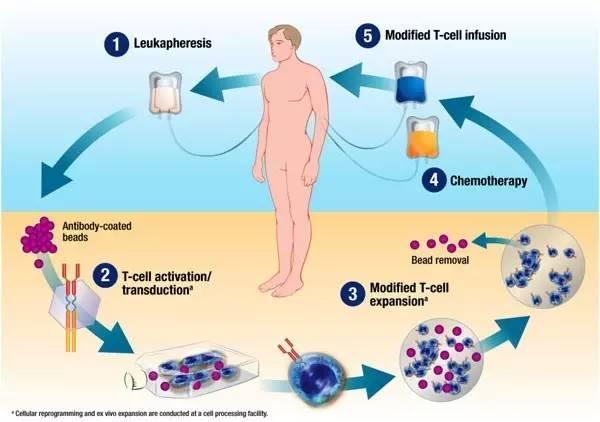
CAR-T基因改造疗法过程。图据网络
宾夕法尼亚大学研发CAR-T治疗法团队的负责人卡尔?琼博士将这种改造后的T细胞称为“连环杀手”,仅一个改造后的T细胞就可以杀死10万个癌细胞。目前,CAR-T主要用于急性淋巴细胞白血病。
根据《纽约时报》报道,诺华公司向FDA提供的主要证据来自对63名患者的研究数据,这些人在2015年4月至2016年8月期间接受了该项治疗。其中52人(82.5%)的病情得到好转,对于复发或难治性急性淋巴细胞白血病(ALL)患者这类危重病来说,这是极其高的救治率。
四川新生命干细胞科技股份有限公司副总经理、中国医学科学院北京协和医院研究员陈强告诉红星新闻,白血病只是一个统称,具体病情很复杂。根据恶性程度,5年存活率有很大差异,像复发或难治性急性淋巴细胞白血病(ALL)这种最恶性的,就很难说,一般存活率都非常低。
根据《人民日报》报道,急性淋巴细胞白血病患病儿童通过化疗,90%可以缓解,60%到70%可以治愈,5年存活率达75%-82%。但仍有30%左右的病人需要骨髓移植治疗,这一部分就是所谓的难治性急性白血病。尽管治愈率并不高,很多父母还是决定“赌一把”,这部分病人可能已经尝试过所有治疗方法,不幸的是都失败了,而CAR-T的出现则能拯救这部分最难医治的人群。
参与研究的美国白血病和淋巴瘤协会的首席医疗官格温?尼克尔斯博士称:“这是一个全新的世界,一项令人感到振奋的治疗方式。”
案例
患者现身说法:可痊愈、没有化疗痛苦
12岁女孩艾米丽?怀特海德是第一位接受白血病基因改造治疗的儿童。据《纽约时报》报道,她和父亲一同出现在周三FDA肿瘤药物专家咨询委员会的会议上,呼吁委员会批准这种挽救了她生命的治疗方式。2012年,当时只有6岁的艾米丽在费城儿童医院接受了一项研究性治疗。尽管出现了严重的副作用——高烧、血压下降、肺充血。但她成功摆脱了癌症,并且至今没有复发。

12岁的艾米丽·怀特海德和她的父母出现在FDA会议上。图据纽约时报
“我们相信如果这项治疗得到批准,将拯救世界上成千上万儿童的生命。”艾米丽的父亲汤姆?怀特海德在会议上告诉专家咨询会:“我希望有一天在场的各位能告诉你们的后代,你们是终止将化疗和放疗这类有毒药物治疗作为标准治疗的一份子,并将血癌变为了可治愈的疾病,即使在复发后大多数人仍然存活。”
除了艾米丽一家外,另一名家长唐?麦克马洪也出席了会议,他的儿子康纳从3岁起就受到严重复发性白血病的折磨,长达12年之久。麦克马洪在会上展示了儿子康纳在接受治疗期间受到痛苦折磨的照片,他还称化疗导致儿子无法生育。
一年前,当他们了解到细胞治疗法时,一家人正准备进行骨髓移植,随后他们决定立刻带康纳到杜克大学接受细胞治疗。接受治疗之后,康纳甚至重返冰球场。与需要数十次骨髓穿刺和痛苦的骨髓测试的传统治疗相比,T细胞治疗不至于让人饱受折磨。
第三位家长艾米?卡彭同样建议专家组批准这项治疗,尽管她5岁的女儿索菲亚接受细胞治疗后仍离开了人世。但这项治疗确实缓解了索菲亚的症状并给了她额外的几个月生命时间。艾米?卡彭称,索菲亚在接受细胞治疗时病症已经十分严重,如果可以早点治疗,女儿可能还活着。她说:“我们希望更多家庭可以拥有更长的时间和孩子一起与病魔作斗争,每个孩子都值得拥有这样的机会。”
风险
担忧副作用,但不足以妨碍批准
周三的会议上,专家们并没有对该治疗展现的救命潜力提出质疑。但他们对于治疗可能的风险表示担心,短期风险包括艾米丽所经历的严重副作用,而长期风险则包括注入的细胞是否会引发其他问题,并对于诺华公司在扩大生产规模后,是否能在治疗过程中保持一致性及保证质量提出了担心。

专家们准备将患者T细胞进行基因改造。图据美联社
诺华公司则回应称,肿瘤专家们已经掌握如何应对出现严重副作用的方法。关于长期风险至今还没有出现,但这并不能彻底排除可能性,公司承诺将把所有接受治疗的患者登记在册并持续跟踪观察15年。
考虑到治疗过程很复杂,并且病人需要特殊看护以控制产生的副作用,诺华公司称,初期将不会广泛推广,因为急性淋巴细胞白血病患者并不普遍,在美国,一年新增患者只有5000名,其中复发或难治性患者只占15%。
因此,诺华公司计划指定全美30至 35 个医疗中心实施治疗,这些中心的医护人员将参加大量培训,并且只有得到许可后才能上岗参与医护工作。
专家咨询委员会通过评估一致认为,这些潜在风险都不应该妨碍FDA对CAR-T治疗法的批准。加州希望之城国家医疗中心肿瘤专家拉里?夸克称:“我认为这些忧虑中的任何一点都不能阻碍这项迄今为止取得的杰出临床结果。”
而至于Tisagenlecleucel (CTL-019)治疗法是否将运用到其他国家,诺华公司发言人朱莉?马斯称,一旦获得批准,医疗中心将会自行决定是否接收外国患者。她同时表示,今年晚些时候,公司将向欧盟提交申请批准文件。
此外,诺华公司表示,已经开始将类似基因疗法运用于其他恶性肿瘤治疗的试验中,希望能取得更多成果。
延伸
中国CAR-T治疗进入临床试验,研究数量仅次于美国
红星新闻查阅资料发现,CAR-T基因治疗法在中国也已进入临床试验阶段。
据《文汇报》报道,去年年底,第二军医大学附属长海医院就已宣布,在长海医院血液科,CAR-T技术在难治复发急性淋巴细胞白血病的临床试验中,已治疗的14例患者都得到不同程度的控制,其中12例急性淋巴细胞白血病患者达到完全缓解,2例症状稳定,至今无一例病人因严重并发症而死亡。
这也并非国内唯一的成功案例,据南方网报道,从2015年开始,深圳市第二人民医院血液科与从美国引进的王荣福教授“孔雀团队”合作,开展CAR-T疗法的临床试验。CAR-T技术在该院开展的难治性及复发性急性淋巴细胞白血病和B细胞淋巴瘤临床试验中,已治疗的3例患者都得到不同程度的控制,其中1例急性淋巴细胞白血病患者达到分子生物学上的完全缓解,也就是白血病肿瘤基因完全转阴,而2例淋巴瘤患者也达到完全缓解,体内找不到癌灶。
据梅斯医学期刊显示,中国在CAR-T上的研究不落后于西方国家,中国在ClinicalTrials.gov登记的CAR-T相关临床研究数量仅次于美国。除了大手笔引进Kite制药CAR-T产品中国市场开发权利的复星医药外,国内其他在CAR-T疗法布局的公司还包括西比曼、博生吉、安科生物、恒瑞医药、中源协和等。
如今诺华公司的CTL-019获得FDA专家的推荐批准无疑为全世界增加了这些公司的信心。这一里程碑式的重磅事件,将引领更多医学专家投身这项事业中,激励更多医药公司积极开发此类药物。











