目前关于癌症治疗,主要有两个大的方向。一种是通过诱导人体全身的免疫系统,主要集中在PD1、PD-L1靶点的抑制剂研究。另一种便是最近半年来持续刷屏的CAR-T疗法,需要从病人体内分离T细胞,并进行特异性的基因编辑,然后攻击癌细胞。前者往往有较强的副作用,而后者不得不面对高昂的治疗费用和冗长的治疗周期。
自从去年FDA批准了第一个CAR-T疗法至今,癌症治疗领域喜讯不断,而唯独这项研究,在成果第一次发表就验证了对多种癌症的治疗效果,并且凭借周期短、成本低,加上在小鼠身上100%的治愈率,几乎抢尽了CAR-T的风头,这是怎么回事呢?
首先介绍一下,这项研究的领队
Ronald Levy教授。他是癌症免疫疗法的先驱,目前执教于斯坦福大学。第一个用于人类抗癌治疗的单克隆抗体——利妥昔单抗的上市就是得益于他的研究。

Ronald Levy教授,来源PNAS
是不是看上去慈眉善目的,简直就是癌症患者的圣诞老人,总会给癌症病人和家庭带来生命的希望。在科研上Ronald Levy教授更是宝刀未老,古稀之年仍活跃在科研第一线。

Ronald Levy和Dr. IditSagiv-Barfi ,图片来源med.stanford
我们回到Ronald Levy教授这个里程碑意义的研究。根据他的观点,这种新的方法只在肿瘤内部刺激免疫细胞,绕过了肿瘤的特异性靶点,而且不需要系统地激活免疫系统,也不需要(像CAR-T那样)根据患者病情进行私人定制,只需要微量的2种分子。(⊙o⊙)好吧,你牛你说了算。
Ronald Levy教授团队的实验是怎样进行的呢?众所周知,人体的T细胞可以识别肿瘤抗原并分泌抑制因子,但是当肿瘤形成以后,T细胞和肿瘤细胞的平衡关系会倾向于免疫抑制。Levy实验室通过筛选可以重新激活T细胞的药物,并将药物直接注射到肿瘤部位来重新激活肿瘤特异性的T细胞。
这两种“神药”分别是:
CpG寡核苷酸
也就是TLR9的CpG岛配体,可以调节附近的免疫细胞一起发挥作用,促进T细胞膜上OX40受体的表达扩增;
OX40抗体与T细胞表面的受体结合,使T细胞重新被激活,恢复对肿瘤细胞的杀伤能力。
因为这两种药物直接注射到肿瘤中,所以只有浸润在肿瘤细胞中的T细胞被再次激活,也就是说,这些T细胞已经被肿瘤细胞“预先筛选”过,只能识别该肿瘤的特异性蛋白,Ronald Levy教授认为,他们的方法不会受限于癌症的种类,因为癌症细胞已经被免疫系统贴上了特异性的标签。目前,这项研究已经在淋巴瘤、乳腺癌、结肠癌、黑色素瘤的小鼠身上得到了证实。
这种新型的“癌症疫苗”具有令人惊喜的效果:向小鼠肿瘤部位注射这两种分子后,小鼠其他部位的肿瘤会一同被消灭。患有多种肿瘤的小鼠,在向一肿肿瘤注射两种分子后,小鼠身体其他部位、和这种肿瘤具有相同识别靶点的肿瘤也一同被消灭。90只实验小鼠,有87只通过这种“癌症疫苗”得到痊愈,其余3只在第二次治疗中获得痊愈。没错,治愈率100%。
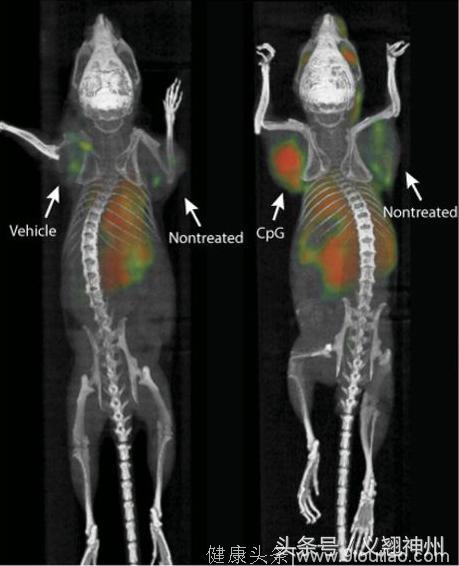
实验图
随着分子生物学研究的深入,借助于现代先进的科研仪器,科研工作者把注意力集中到细胞靶点、细胞识别上。Ronald Levy教授独辟蹊径,巧妙地把鉴定靶点这么关键的工作通过空间定位来完成。惊不惊喜,意不意外?
极少的药量,无严重副作用,治疗周期短,成本低廉,更可喜的消息是,这个疗法很快将会开展治疗低度恶性淋巴瘤的一期临床试验,大家在这里与义翘神州一起拭目以待。
这篇论文已经发表在1月31日的Science Translational Medicine上,有需要的同学可以在文章下留言。
最新的生物热点资讯,关注"义翘神州"!