肿瘤免疫治疗领域在这几年开始以惊人的速度蓬勃发展,投资者在这一领域投入了数十数百亿的资金投入。通过增强自己的免疫力来治疗肿瘤,免疫治疗给肿瘤治疗带来了新的希望。随着第一个免疫检查抑制点的成功,许多人开始关注到CAR-T技术,它正在成为下一个肿瘤治疗的具有爆发力的市场。
诺华和吉利德旗下的凯特制药的疗法最先获批,全球还有数百个正在进行中的临床试验。
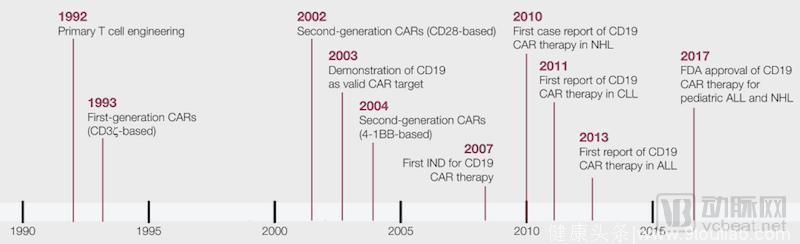
但我们不禁要问,CAR-T真的有希望治愈所有的癌症吗?这项技术真的值的人们对其赋予这么高的期望?治疗过程中伴随严重的副作用,某些临床试验中还存在死亡案例,这项技术真的准备好了吗?昂贵的治疗费用,真的值得付出吗?
未来,我们应该对这项技术有哪些期待,又有哪些必须的认知?
神奇的技术到底是什么?
“CAR-T既是细胞疗法,同时也是基因疗法和免疫疗法。它是完全背离药物治疗的新技术。“Juno制药联合创始人Michel Sadelain这样表示。
T细胞是免疫细胞的一种,我们可以把它们看作免疫系统下的一个个士兵。当人体的免疫系统收到攻击的时候,这些士兵就会出动去消灭入侵的病毒、病原体、以及发生癌变的细胞。
但除了入侵的病原微生物、病变的细胞外,人体内还有许多正常的细胞。免疫细胞在作用的过程中并非“遇神杀神,遇佛杀佛”,他们是如何甄别“好细胞”与“坏细胞”的呢?
细胞表面存在许多抗原,这些抗原好比细胞和细胞之间的“暗号”。T细胞正是通过这些“暗号”来区分哪些是自己人,哪些是入侵者。
然而,肿瘤细胞是一群非常狡猾的家伙。当T细胞过来让肿瘤细胞对暗号的时候,这些家伙有很多方法可以迷惑T细胞,让T细胞以为它们是自己人,逃避T细胞的识别和攻击。没有了T细胞的威慑,这些具有不死性的肿瘤细胞将在人体内无限繁殖。
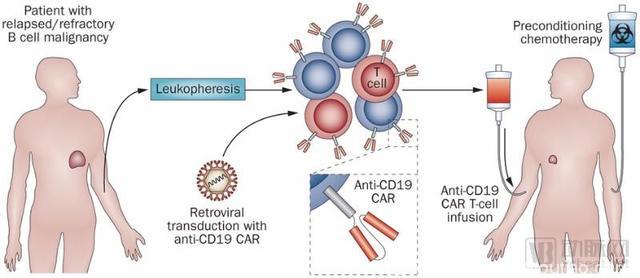
CAR-T细胞其实是T细胞和CAR(嵌合抗原受体)细胞的结合体。CAR细胞是CAR-T细胞的核心部件能够赋予T细胞肿瘤抗原的识别能力。这就好比给了T细胞一副火眼金睛。
在CAR细胞的帮助下,T细胞军团将如虎添翼。新细胞能够识别来自肿瘤细胞的特定抗体。同时,当与肿瘤细胞结合后,CAR-T细胞内部的T细胞将被激活,对肿瘤细胞进行靶向攻击。
第二代和第三代的CAR-T细胞还拥有额外的刺激区域,能够更有效的增强免疫应答。
通常,CAR-T细胞治疗的第一步是病人T细胞的提取,这一步骤也被称作白细胞清除术。这些T细胞将在体外进行基因改造,并修饰上CAR细胞,再在体外进行扩增。最后,这些改造后的细胞将被重新输入回体内,准备与肿瘤细胞抗战。
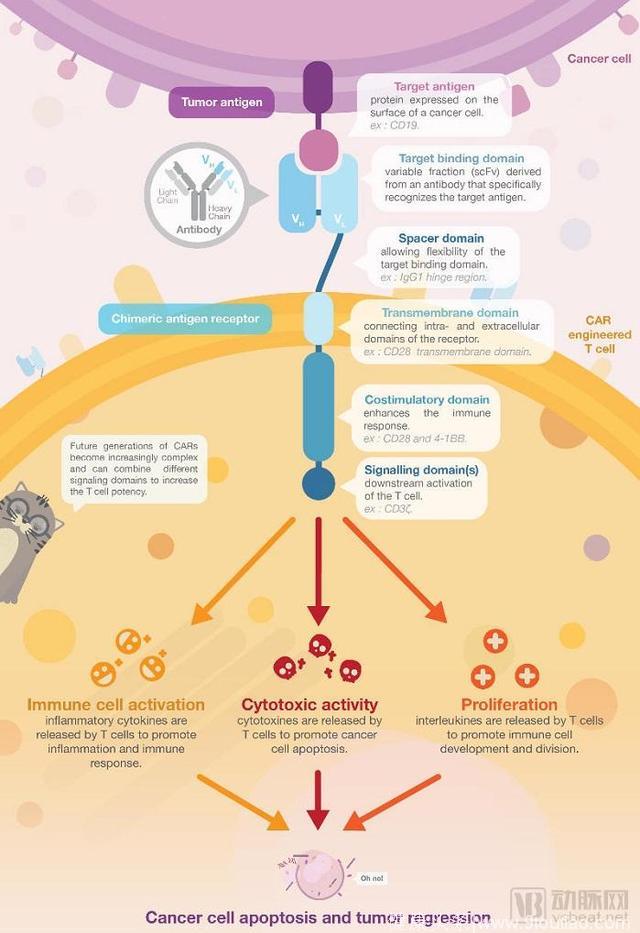
CAR-T如何力挽狂澜
基于免疫疗法的检查点抑制剂在肿瘤治疗上取得了成功。他们通过抑制肿瘤的逃逸机制来增强T细胞对肿瘤细胞的杀伤效果。而基于细胞免疫疗法的CAR-T疗法则通过增强免疫系统对肿瘤抗原的捕捉能力,让T细胞对肿瘤细胞的杀伤效果再上台阶。
CAR-T疗法在临床试验中显示出了非常可观的缓解率,对94%的严重肿瘤显示出效果。这是非常让人惊喜的,因为大多数CAR-T临床实验招募到的患者都是在使用了其他疗法之后,没有应答的。从疗效来说,CAR-T的表现超出了患者和投资者的预期。但凡事都有两面,CAR-T也有缺点。
Cellectis CEO André Choulika,在一次采访中透露:“我必须要强调,CAR-T技术不是魔法。”
的确,CAR-T细胞在抵抗肿瘤的过程中也会带来严重的副作用,比如神经毒性和细胞活素释放综合症。2016年,几家公司报告了在CAR-T治疗临床后期的几例死亡案例。这让我们意识到,这项技术并非我们呢想象的那样完美。
目前绝大多数的CAR-T疗法所应用的都是B细胞上的CD19靶点。目前所有领先公司的CAR-T疗法都是CD19,大部分应用于B细胞恶性肿瘤的治疗,比如淋巴瘤和白血病。
“一开始的结果太好了,CD19被快速的开发并推向了临床。”Celyad研发副总裁David Gilham谈到,“但正是由于这样快节奏的推进,使得研究缺乏良好的临床前模型,再加上非常严重的毒副作用,阻止了技术的继续前进。”好在由于样本量的积累,潜在机制研究的不断完善,相关方法也在不断改进。
谁在做CAR-T?
诺华在2017年8月第一个推出CAR-T疗法,产品名称叫做kymriah。该疗法主要针对急性B细胞淋巴细胞性白血病。在临床试验中,83%的患者在三个月后出现了病情缓释,这些患者都是在标准治疗中没有出现应答的。
但与疗效并存的是毒副作用,49%的缓和在治疗过程中伴随强烈的细胞因子释放综合症(CRS)。这种副作用也是诺华的对手公司在临床试验中出现死亡案例的原因。比如,2017年3月,Juno就曾因为临床试验中出现了5例脑水肿死亡患者不得不终止实验,当时其实验进度要领先于诺华。
吉利德是第二个获批的公司,他通过收购凯特制药占领了市场先机。吉利德的疗法叫做yescarta,其针对的是另一种血液癌症,叫做侵袭性B细胞非霍奇金淋巴瘤。该疗法在临床试验中表现出了72%的缓释率,但总共有三人在治疗过程中死于副作用。
其他正在进行临床试验的公司还包括Juno、美国的Celgene 以及Mustang Bio,比利时的Celyad,法国的Sevier(该公司于Pfizer合作进行)。
如何优化CAR-T治疗
尽管在临床试验中伴随严重的副作用,并且还出现了死亡人数。尽管一些人在争论着种疗法是否值得冒险,但对患者而言,他们并没有选择的余地。但值得欣慰的是,一些玩家正在改进CAR-T细胞,让治疗过程更安全。
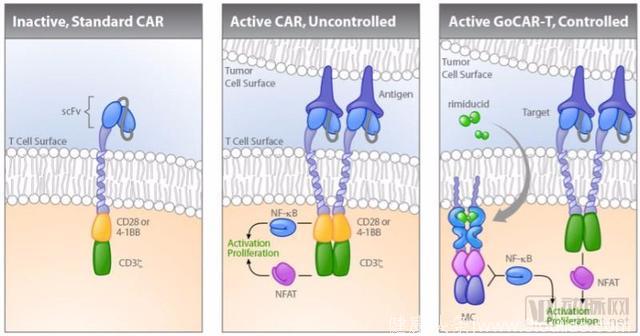
Cellectis 是其中一家,这是一家法国公司,他们的CAR-T疗法叫做ucart19。这家公司已经与Sevier和Pfizer签署了授权协议。Cellectis授权的是一个开关控制系统,只有在给患者注射雷帕霉素药物时,T细胞才能被激活。在人道主义情况下,该公司成功的挽救了两名患有侵略性白血病儿童的生命,该疗法也随之进入临床 I 期阶段。Bellicum制药是一家美国公司,该公司正在开发一种类似技术叫做GO CAR-T,需要使用一种叫做rimiducid的药物才能够激活CAR-T细胞。
这只是一部分,Celyad是一家正在发展一种能够让T细胞自然杀死受体细胞的一种CAR-T技术。
“这是具有颠覆意义的,因为NKR-2结合了8种不同的配体,能够作用于80%以上的实体瘤和血液肿瘤。“该公司联合创始人兼CEO Christian Homsy表示,“我们正在进行行业内最大、最广泛的一次试验,总共针对了7种标志物。“
如果能够成功,Celyad的CAR-T细胞将完成人类医疗史上的一次壮举。因为实体瘤的治疗一直是免疫肿瘤学领域的一个挑战。其中主要原因是实体瘤中T细胞的渗透率低,同时在免疫环境中,肿瘤细胞能够逃逸免疫细胞。
蓝鸟生物是苏格兰TC制药的合作伙伴,这家公司同样拥有能够用于实体瘤治疗的CAR-T技术,他们所使用的是一种特殊的T细胞,叫做γδT细胞。这种细胞的神奇之处就在与能够选择性的标记肿瘤细胞,不会对健康细胞进行攻击,能够有效的降低治疗过程中的副反应。
以上是通过调节T细胞来提升安全性,另一个策略则是通过CAR-T细胞与其他类型的免疫疗法相结合。比如将其与免疫检查点抑制剂联合作用,阻断肿瘤细胞对T细胞的逃逸机制,从而增加治疗疗效,并且降低使用剂量。
但是,这样的方法可能会让治疗成本再上一层,单是CAR-T和免疫抑制剂的价格都非常昂贵。
不过,我们应该积极的看待,技术成熟后,成本一定是会下降。三十年前,生产一克单抗或者蛋白药物可能要花几千美金,副作用也很大。而到了今天生产一克单抗的成本只需要100到200美金。同样的道理,现在CAR-T的成本和价格都很高,但从技术发展角度来说,未来成本是会陆续降下来的。
利用异源CAR-T细胞,降低治疗成本
CAR-T治疗的费用一直在市场上受到争议,两款已上市的疗法价格分别是47.5万美元(诺华)和37.3万美元,这还不算治疗过程中的其他费用(比如住院、副反应用药等)。有专家估计,如果所有的费用算在一起,每个患者所花费的费用将达到150万美元。
如何降低成本?异源CAR-T治疗是目前呼声较高的一种方式。即从健康人体中提取到T细胞,这就使得细胞采集过程更偏流水化,省去了在每个病人身上单独采取的成本。
Cellectis 和Celyad 都在发展异源CAR-T细胞技术,这也使得两个公司间产生了一些摩擦。cellectis是第一个在临床试验中使用两种现成的CAR-T细胞,一种是他们授权给Servier 和Pfizer的,另一种则是异源细胞。另外,Celyad的异源细胞仍处于临床前阶段,该技术已经给诺华授权。
这样的技术更快,也更便宜,但发展现成细胞技术仍然是“科学领域的挑战”。Celyad CEO Christian Homsy表示:“我在想异源CAR-T细胞是否能成为 真正的现成疗法。“他表示,”免疫学仍然有很多挑战需要去突破,比如制造、运输、存储等,必须要达到患者治疗过程的标准和规模。“
即便科学家克服了技术上的一些挑战,这项技术依然面临法规的要求。这是一项全新的技术,在不同国家和不同国家之间,监管有很大的不同。
挑战是多方面的,技术也显然不是完美的,但CAR-T的面世给了许多患者新的希望。随着第一个产品进入市场,后续将有更多的产品面世。
细胞治疗可能成为下一个主流的治疗方法,但这项技术的门槛非常高。换个角度来看,基因治疗、细胞治疗以及抗体治疗是这些年的三大技术产品,对多个技术同时掌握,才能做出高质量的CAR-T细胞。因此,CAR-T公司要想走的远,技术储备上需要下硬功夫。
更多前沿互联网医疗资讯请关注动脉网公众号:vcbeat,后台回复关键词(如:人工智能、基因检测),即可获得相关独家前沿资讯文章!
动脉网(vcbeat.net),关注互联网医疗及健康领域的新技术、创业和投资,以及新技术背后的伦理。
网站、公众号转载请联系动脉网公众号:vcbeat