作者:史博文,孙冰生,岳东升,张钰,李晨光,高留伟,黄武浩,王长利
单位:天津医科大学肿瘤医院肺部肿瘤科,国家临床医学研究中心,天津市肿瘤防治重点实验室,天津市肺癌诊治中心
上世纪90年代初,胸腔镜技术引入胸外科领域后,微创胸外科技术得到广泛的发展,从四孔到单孔胸腔镜肺叶切除术不断发生演变,大大推动了普胸外科的发展,降低了对患者的创伤,远期预后与传统开胸手术并无差异。尽管如此,胸腔镜介导微创外科仍然有其局限性,包括二维操作视野、手眼非同一直线的分离操作、操作器械的灵活性差,不能满足复杂的胸外科手术需要。基于此,上世纪90年代中期,机器人开始应用于外科手术,而广泛应用于胸外科肺叶切除大约从2005年以后。新一代的达芬奇机器人手术操作系统具备高清的三维操作视野、手臂无抖动、镜头固定、活动范围广、器械移动度大等优点,并且改变了术者站在手术台旁操作的传统模式,由主刀医师坐在控制台前完成手术全过程,符合人体工程学原理,更适合于长时间的复杂手术。天津医科大学肿瘤医院自2016年初引入达芬奇手术操作系统,截止2016年8月份,已完成手术80余例, 同期完成腔镜肺叶切除66例,现就两组患者相关临床数据进行分析比较。
1.资料与方法
1.1 患者选择
回顾性分析2016年2月至2016年8月天津市肿瘤医院肺部肿瘤科同一术者对66例患者行胸腔镜肺叶切除术和35 例患者行机器人辅助肺叶切除术。 入选标准:(1)排除远处转移;(2)术前未接受新辅助治疗;(3)均未见明显淋巴结转移,可行胸腔镜或达芬奇机器人手术;(4)患者均接受肺叶切除+系统性淋巴结清扫,包括肺门及纵隔淋巴结的切除。所有患者的组织学类型根据世界卫生组织(WHO)2011 版。 肿 瘤 分期 根 据最 新 国 际 肺 癌 研 究 协 会( IASLC)TNM 分类标准。所有患者术前影像学检查均未见明显淋巴结转移,可行胸腔镜或达芬奇机器人手术。根据患者经济情况及患者意愿选择相应手术方式。
1.2 手术方法
1.2.1 机器人组手术方法
(1)切口设计:机器人系统为DaVinci Si system(CA), 镜 孔(12 mm)选在腋中线9肋间,手术过程中镜头30°向下,放置第一臂和第二臂以及分离粘连时采用30°向上,第一臂操作孔(8 mm)和第二臂操作孔(8 mm)根据左右肺不同可选腋前线稍微偏前和肩胛下角线稍偏后第6肋间和第9肋间,一般不用第3臂,辅助操控孔下肺可选择腋前线第7肋间,上肺选择在腋后线第8肋间,大小约3~4 cm, 主要协助牵拉肺、放置吸引器和直线切割缝合器以及拿取标本。切口位置并非绝对,根据患者体型大小及左右肺的不同可做稍微调整,见图1。所用器械包括电灼钩(cautery hook)、无损伤抓钳(cardiac forcep)、双极抓钳(double fenestrated graspers),手术过程中无需要人工气胸。
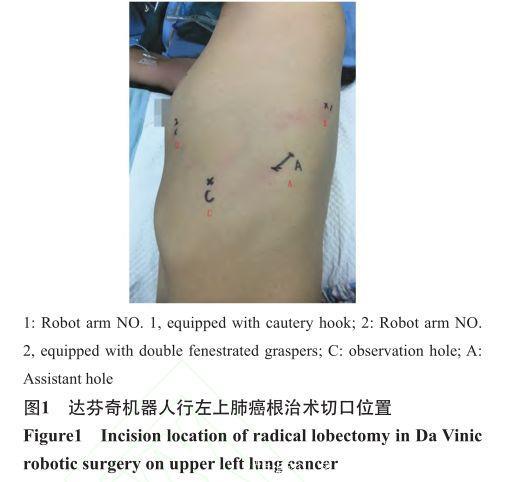
(2)体位和麻醉:气管内插管全身麻醉,90° 侧卧折刀位,胸下垫垫。手术野常规消毒铺巾, 避免镜头机械臂对髋骨的压迫,增大肋间隙,减少穿刺器对肋间神经的压迫损伤,减轻术后伤口疼痛。机器臂系统放置在患者的头侧,助手站在辅助操作孔的一侧。
(3)机械臂的安装:首先安装镜头臂,切开皮肤和皮下组织,然后用穿刺器直接穿刺进入胸腔,进入胸腔的穿刺器部分不能过长容易影响操作视野,将穿刺器胸外部分与镜头臂连接,在镜头30°向上引导分别放置1臂和2臂的穿刺套管,注意1臂的穿刺套管位置不能太高,尤其对于胸廓比较大的患者,如果位置高可能导致1臂的器械不够长而无法行下肺韧带和膈肌的操作。安装完毕机械臂后再将电灼钩和双极电凝分别安装在1臂和2 臂,轻推器械进入胸腔并指向患者头侧。
(4)手术操作:术者坐在操控台,通过操控台前的内窥镜观察术区,术野放大15倍,术者左右手的食指和拇指分别套在操控手柄,脚踏板完成镜头及机器臂相关设备的切换及操作。手术台旁常规设置1~2名助手和1名器械护士,助手首先通过辅助操作孔一手放置双关节卵圆钳,牵拉肺组织暴露手术操作部位,另一手拿吸引器协助, 术者左手操控2臂用双极电凝协助暴露术野,右手操控1臂用电钩进行解剖,打开纵隔胸膜及肺裂。在解剖过程中,有时1臂需要将电钩更换为无损伤心包钳,主要用于分离、结扎小的血管以及牵拉肺组织暴露术野方便助手放置切割缝合器。助手通过辅助操作孔放置血管切割缝合器完成动脉、静脉及支气管的切割缝合操作。与胸腔镜比较, 机器人辅助操作因为视野更加放大,可以更加清楚地观察到淋巴结周围的解剖结构,避免损伤邻近器官。
1.2.2胸腔镜组手术方法
术者使用3切口进行操作,使用30°角胸腔镜。首先沿髂前上棘延长线第7肋间作一2 cm切口作为观察孔,置入套管放入胸腔镜进行观察。根据不同手术方式设计第2、第3个切口。一般在腋前线和肩胛下角线后约1 cm 肩胛骨旁约2 cm分别作3~4 cm切口。使用器械包括长卵圆钳、吸引器、电灼钩、直线切割缝合器等。
1.3 临床观察指标
(1)手术时间:从患者麻醉开始至麻醉结束拔除气管插管所用时间;(2)术中出血量;(3)清扫淋巴结站数;(4)清扫淋巴结个数;(5)术后带管时间:从手术至拔除胸腔引流管所用时间,当胸腔内无气体排出,24 h胸腔引流量在100 ml以下时拔除胸管(机器人手术及胸腔镜手术术后常规放置1~2根胸引管);(6)术后总胸腔引流量:术后拔除胸管前每日胸腔引流量总和;(7)术后住院时间:从手术至出院所需时间。
1.4 统计学方法
采用SPSS18.0软件进行统计分析。计量资料以均数±标准差表示。组间均数比较采用方差分析, 计数资料组间比较采用卡方检验,P<0.05为差异有统计学意义。
2.结果
2.1 两组患者基本情况
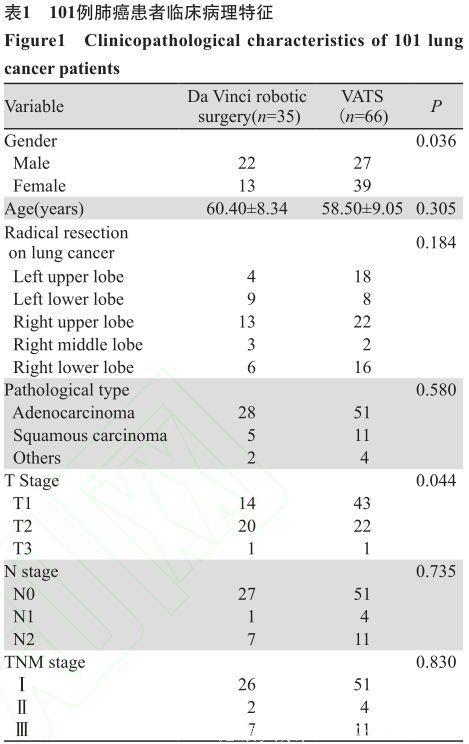
机器人组男女比例为22:13,胸腔镜组男女比例为27:39(χ2=4.41, P=0.036)。机器人组平均年龄(60.40±8.34)岁,胸腔镜组平均年龄(58.50±9.05)岁(t=1.031, P=0.305)。所有患者均行标准肺癌根治术,即肺叶切除+系统性淋巴结清扫,包括肺门及纵隔淋巴结的切除。术后病理结果显示腺癌79例,鳞癌16例,其他类型6例,术后病理分期Ⅰ期77例,Ⅱ期6例,ⅢA期18例。除性别外, 患者年龄、病理类型、分期和接受术式等方面差异均无统计学意义(P>0.05),见表1。
2.2 两组患者手术结果
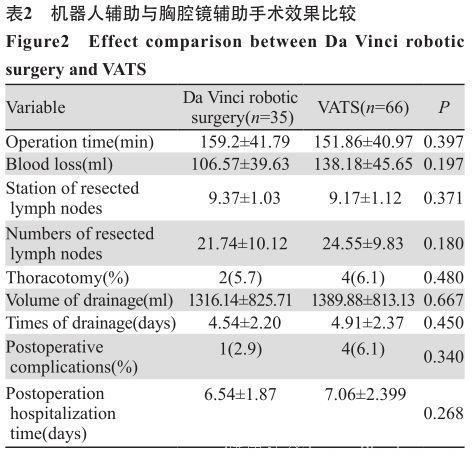
两组患者数据对比,差异均无明显统计学意义(均P>0.05)。其中6例中转开胸患者均是因为术中探查发现质硬淋巴结包绕肺动脉分支,考虑安全因素转为开胸手术。两组均无死亡病例, 见表2。
3.讨论
随着胸外科手术技术与腔镜器械的发展,胸腔镜外科目前已广泛应用于国内许多医学中心。与传统开胸手术比较,其优势主要表现在缩短了住院时间、术后疼痛减轻、术后肺功能提高以及较低的术后并发症。从肿瘤学角度看,许多研究显示胸腔镜手术后的局部复发及远期生存与传统开胸手术相似。但是无可否认的是胸腔镜手术操作存在很多局限性,包括手术器械的操作角度和范围、术者的视野控制以及清扫淋巴结的程度和范围都很难做到“随心所欲”,尤其复杂手术涉及到的气管血管重建和吻合都不如开胸手术操作的方便和流畅。而机器人手术从某种意义上是对胸腔镜微创外科进一步的延伸和提高,弥补了传统胸腔镜的很多不足之处,进一步提高了视野的清晰度和手术器械的操作范围和灵活性,并能过滤手术过程中的手颤抖,明显降低了手术操作的难度。Okada等于2000年首先报道了通过声控机器臂和一个牵拉系统,由一名医生独立成功对一例女性右肺中叶癌实施了肺大部切除和淋巴结切除。机器人手术在普通胸外科领域的应用没有经历VATS的由简到繁、由良性疾病到恶性疾病的过程,而很快便被应用到胸部肿瘤外科,实施肺癌根治性切除及淋巴结清扫。其主要原因在于机器人手术能够通过机械手臂模拟人手进行精细操作,在胸腔内完成较复杂的游离、结扎、切除等动作,而术者可以借助高清晰度3D影像系统直接控制和观察胸腔内机械手及病灶情况,真实感极强,符合外科手术直视操作的习惯。系统对图像的放大可达10倍以上,能达到彻底清除肿瘤和淋巴组织并保留正常结构的效果。这些优点大大改进了传统VATS手术的不足,为机器人手术在胸部肿瘤外科的广泛应用奠定了基础。
目前对机器人辅助肺癌根治术的应用仍存在争议,很多学者认为与传统VATS比较,机器人手术并无明显的微创优势。来自美国普胸外科医师协会的数据(STS-GTS)比较了这两种微创手术的优劣。该研究筛选2009—2013年Ⅰ期和Ⅱ 期的NSCLC患者,其中1220机器人手术患者, 12 378例VATS患者,基线资料显示机器人手术患者的年龄大,肿物大小也较VATS组大,结果显示机器人手术时间更长(中位数 186 min vs. 173 min, P<0.001);两组并发症相似(0.6% vs. 0.8%,P=0.4),中位住院时间都是4天,淋巴结清扫两组是相似的,但是机器人组似乎更适合做稍大一些的肿瘤。总之,除了手术时间机器人稍长外, 其余包括术后并发症、住院时间、30天术后死亡率及淋巴结升期都显示两者的疗效是相似的。Radkani等回顾性分析331例机器人手术患者,其中79%行肺叶切除,17%行楔形切除,1.5%行全肺切除,11例患者未行肺切除,6.9%中转开胸,平均手术时间185.63 min,平均住院时间5.52 d,平均术中出血量47.85 ml,8.8%患者出现术后并发症。目前机器人手术难以普及的最重要原因是费用昂贵,一套机器人系统的投入需要数百万美金,且每年需投入升级、维护等费用,非一般医疗机构所能承受。机器人手术器械耗材等未纳入医保范围,患者经济负担较腔镜重。同时,尚无研究证明机器人手术患者的远期生存与胸腔镜手术及传统开胸手术之间有无差别,或能否从中受益。
本研究的两组患者临床基本特征中,性别及肿瘤T分期差异存在统计学意义。胸腔镜及达芬奇机器人手术适合所有患者,最终手术方式是向患者说明病情后,根据患者自身经济情况及患者家属意愿选择手术方式,因此性别及T分期并未对本研究分组造成影响。本研究数据总体与国外同行的研究一致,尽管结果也显示机器人手术时间比胸腔镜略长,但是差异并无统计学意义。需要说明的是本研究中手术时间并非胸内操作时间,而是从麻醉开始,期间包括了摆放体位、打孔、安装器械臂时间,因此比胸腔镜的术前准备工作更多,这也能部分解释为何机器人手术比胸腔镜手术时间长。术后并发症机器人组略低(2.9%, 1/35 vs. 6.1%, 4/66),中转开胸比率两组相似(5.7%, 2/35 vs. 6.1%, 4/66)。究其原因多为术中探查发现质硬淋巴结紧密包绕血管,考虑手术安全行中转开胸。淋巴结清扫情况两组对比同样未见统计学差异,说明机器人手术可达到与胸腔镜手术同样的手术效果。目前手术对患者所造成的损伤情况并无明确的评估方式,但术中失血量可基本反映手术中对于机体的损伤情况,术后胸引量及引流时间也可部分反映手术创伤程度。本研究中机器人组术中失血、术后引流量及引流时间均略低于胸腔镜组,但差异并无统计学意义,说明在对于患者手术创伤方面,机器人手术与胸腔镜手术并无明显区别,甚至有优于胸腔镜手术的趋势。
本研究中两组数据对比差异均无统计学意义,分析原因可能由于术者行胸腔镜手术例数较多,机器人手术属于开始的学习阶段,胸腔镜手术较机器人手术更为成熟,因此学习曲线可能是造成差异无统计学意义的主要原因。另一方面本研究纳入的样本量较少,且来自于单一中心也可能是造成这一结果的原因。
总之,通过本研究可以发现较传统胸腔镜而言,机器人手术学习曲线时间短,易上手。适应证较胸腔镜扩大,对于全胸腔粘连、复杂的胸外科手术( 包括重建、吻合) 更有优势。机器人手术带给术者的那种如同直视下操作的“随心所欲”、处理突发事件的信心、体力和精力的节约是电视胸腔镜手术无法比拟的,这些无形的优势是无法用数据来衡量的。虽然目前的数据显示机器人手术在术中失血量、带管时间、术后并发症、术后胸腔引流量及术后住院时间与胸腔镜手术差异并无统计学意义,但是这并不意味着两者未来在胸外科的地位是等同的,如同既往我们反复比较开胸手术与电视胸腔镜手术在肺癌根治术中的地位。相信随着手术技术的不断改进,精细手术器械的诞生及耗材成本的下降,机器人手术必将在肺部肿瘤外科治疗中占有更重要地位。
节选自:肿瘤防治研究2018年第45卷第2期












