国内对于结直肠癌的筛查主要依靠粪便常规+潜血,但是敏感性及特异性较差,许多消化道疾病都可以干扰检测结果……
作者 | 张渊博 北京中医药大学东直门医院
来源 | 医学界外科频道
结直肠癌是常见的恶性肿瘤,2012年结直肠癌造成的死亡率为11.7/10万,居全部恶性肿瘤的第五位。
Kaiser Permanente的一项关于腺瘤检出率与结直肠癌风险及死亡关系的研究证实,腺瘤检出率和随访期发生结直肠癌、进展期结直肠癌及晚期癌之间呈负相关。筛查可以通过移除癌前息肉及治疗早期癌变降低癌症死亡率,但是缺乏相应的筛查方法推荐。
结肠镜检查是结直肠癌诊断的金标准,但是受多种条件的制约,无法用作结直肠癌的筛查。国内对于结直肠癌的筛查主要依靠粪便常规+潜血,但是敏感性及特异性较差,许多消化道疾病都可以干扰检测结果,而免疫化学法检测粪便中血红蛋白比愈创木脂便潜血试验更为有效,由于更好的诊断性及参与率,2008年多个美国专业协会一致推荐用粪便免疫化学检测替代粪便隐血试验。
2014年1月,Ann Intern Med刊登了美国加州大学健康研究中心Jeffrey博士团队的研究成果——
“粪便免疫化学检测在发现结直肠癌上具有中等程度的敏感性及较高的特异性,并且有很高的总体诊断精确性。”
Jeffrey博士团队检索了1996年至2013年间Pubmed和EMBASE中的相关研究成果,最终纳入19项研究并进行荟萃分析。结果表明粪便免疫化学检测诊断结直肠癌的敏感性0.79、特异性0.94、阳性似然比13.10和阴性似然比0.23,总体诊断精确性为95%( 置信区间(CI)93% - 97%),单样本检测的敏感性和特异性与多样本检测相似。临床研究的荟萃分析又一次将粪便免疫化学检测的地位推向新的高度。
2016年10月,美国结直肠癌多学会工作组(USMSTF)发布了粪便免疫化学检测用于结直肠癌筛查的新的指南建议,正式向临床医生推荐了这个简单好用的结直肠癌筛查手段,文章在Gastrointestinal Endoscopy、Gastroenterology和the American Journal of Gastroenterology同时发表。
指南认为,粪便免疫化学检测是可广泛应用的筛查手段,具有灵敏、高效、低成本等特点,对结直肠癌筛查的特异性介于94%到96%之间,阳性预测值介于2.9%到7.8%之间(晚期肿瘤33.9%-54%)。指南还推荐粪便免疫化学检测代替基于愈创木脂便隐血检测试剂(gFOBT)。为增加诊断精确度,指南建议粪便免疫化学检测阳性者,应进行结肠镜检查(强推荐,中等质量证据)。
众所周知,疾病处于不断发展过程中,尤其是癌性疾病,进展很快。传统观点是早发现、早诊断、早治疗。究竟不同的时间节点与结直肠癌之间存在着什么样的关系?
2017年4月JAMA发表了“粪便免疫化学检测阳性后接受结肠镜检查的时间与结直肠癌风险及肠癌的诊断分期之间的关联”的最新研究结果给出了答案——
研究负责人Corley及其同事回顾性研究了2010年1月1日2014年12月31日Kaiser医疗机构的1258039名曾接受粪便免疫化学检测的患者,最终纳入70124例,均为粪便免疫化学检测阳性后接受结肠镜检查者,平均年龄61岁。粪便免疫化学检测阳性后行结肠镜检查的时间间隔为暴露因素,依时间不同分为7组,分别为8-30天,2月、3月、4-6月、7-9月、10-12月、12月以上。
70124例诊断为结直肠癌的患者2191例,比率为31‰。相比于粪便免疫化学检测阳性后8-30天内行结肠镜检查的患者,在2个月后、3个月后、4-6个月后、7-9个月后行结肠镜检查的患者结直肠癌风险及晚期疾病的风险无显著差异。10-12个月后行结肠镜检查的患者结直肠癌的风险显著增加,为49‰,晚期疾病的风险也显著增高,为19‰。时间超过12个月的患者风险高达76‰,晚期疾病的风险为31‰。
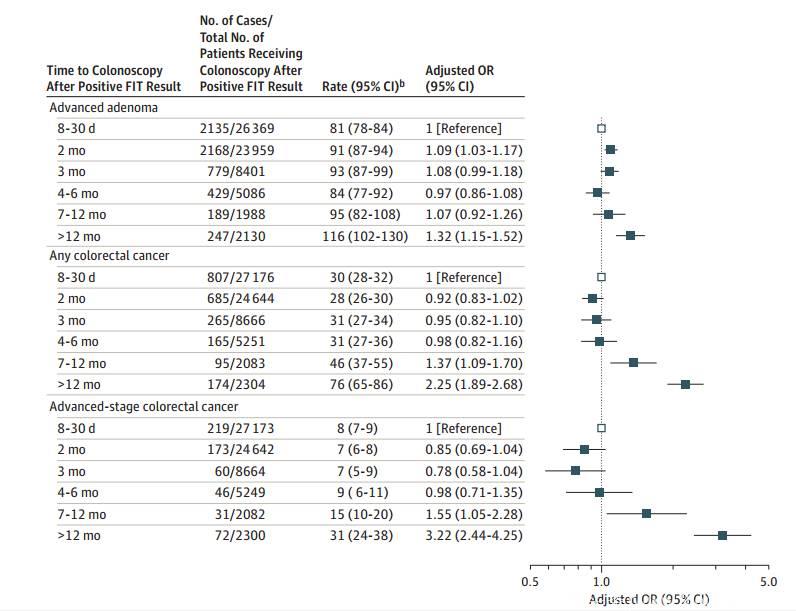
图1. 检测阳性后结肠镜检查的时间间隔和0-IV期结直肠癌的调整风险
该研究表明,相比于在粪便免疫化学检测阳性后的8-30天内接受结肠镜检查的患者,10-12个月后行结肠镜检查的患者结直肠癌的风险更高,并且诊断时疾病已处于更高的发展阶段,并且每增加约30天时间就会增加3%的结直肠癌风险,但是这种关系并不是呈线性的,并且需要进一步的研究来评估这种关系是否是因果关系。
众多研究及指南表明,粪便免疫检测在结直肠癌的筛查中大有可为!有研究认为该方法优于结肠镜检查,可取而代之,但也有研究表明结肠镜检查优于粪便免疫化学检测。
我认为两种方法目的都是为了降低死亡率,对于需要结直肠癌筛查的患者两种方法均可选择,联合使用优势互补,对于无法接受结肠镜检查者,如果没有其他选择,有些人可能就不会再进行筛查,而粪便免疫检测可担此重任,没有必要说其中一个要优于另一个。
参考文献
[1] ChenWQ,Zheng RS,Zhang SW,et al. Report of cancer incidenceand mortality in China,2012[J]. China Cancer,2016,25(1):1-8.[陈万青,郑荣寿,张思维,等. 2012 年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤,2016,25(1):1-8.]
[2] Douglas,Corley,Christopher,Jensen,Amy R.Marks,Wei K.Zhao,AdenomaDetection Rate and Risk of Colorectal Cancer and Death,[J].TheNew England Journal of Medicine,N ENGL J MED 370;14NEJM.ORG APRIL 3, 2014.
[3] Bibbins-DomingoK, Grossman DC, Curry SJ,et al; US Preventive Services Task Force. Screening forcolorectal cancer: US Preventive Services Task Force Recommendation Statement.JAMA. 2016;315(23):2564-2575.
[4] Lee J K, Liles E G, Bent S, et al. Accuracy of fecalimmunochemical tests for colorectal cancer: systematic review andmeta-analysis.[J]. Annals of Internal Medicine, 2014, 160(3):171.
[5] Robertson D J, Lee J K, Boland C R, et al. Recommendations onFecal Immunochemical Testing to Screen for Colorectal Neoplasia: A ConsensusStatement by the US Multi-Society Task Force on Colorectal Cancer[J].Gastroenterology, 2016.
[6] Corley D A, Jensen C D, Quinn V P, et al. Association BetweenTime to Colonoscopy After a Positive Fecal Test Result and Risk of ColorectalCancer and Cancer Stage at Diagnosis.[J]. Jama the Journal of the American Medical Association, 2017, 317(16):1631.