帕尼单抗治疗RAS野生型结直肠癌的补充生物制剂许可申请获FDA批准

▲ Vectibix(Panitumumab)
近日,帕尼单抗(Vectibix,Panitumumab)治疗RAS(KRAS和NRAS第2,3,4号外显子)野生型转移性结直肠癌(mCRC)的补充生物制剂许可申请获得了FDA的批准。该批准是基于一项PRIME研究和Ⅲ期临床试验'0007的回顾性分析。在PRIME试验中,研究人员比较了帕尼单抗联合FOLFOX治疗与FOLFOX单独治疗1183名初治mCRC患者的疗效。结果显示,对于RAS野生型mCRC患者而言,帕尼单抗联合FOLFOX治疗与FOLFOX单独治疗相比,患者无进展生存期(10.1个月 vs 7.9个月)和中位总生存期(25.8个月 vs 20.2个月)也获得了提高。安全性方面,最常见的毒性反应是皮肤毒性。这一批准使得NRAS野生型患者也可以从帕尼单抗中获益,扩大了帕尼单抗一线治疗的适应症。FDA同步批准了Illumina公司新型癌症药物伴随诊断试剂盒Extended RAS Panel。这款基于下一代测序技术的试剂盒在MiSeqDx系统上使用,可以帮助医生判断哪些转移性结直肠癌(mCRC)患者可以用帕尼单抗进行治疗。
基因启动子突变原来也跟胰腺癌发生有关?
过去10年来,肿瘤测序极大推动了癌症靶向治疗的发展。但是,这些测序大部分都集中在仅占基因组2%的外显子上,剩下98%的序列还没有被利用起来。最近,以美国冷泉港实验室为代表的研究瞄准了这剩下98%的基因组序列。研究者收集了308位胰腺癌患者的肿瘤样本,对其启动子序列进行测序,结果发现:有一部分启动子突变与胰腺癌密切相关,其中最突出的是两条信号通路,一条是细胞附着通路,一条是神经轴突导向过程。细胞附着通路之所以与胰腺癌相关是因为癌细胞在扩散的时候会打破附着通路,进入血液循环并转移到其它器官。神经轴突导向之所以与胰腺癌相关是因为肿瘤会顺着神经轴突扩散,压迫神经从而造成患者疼痛。这两种由基因启动子突变导致的通路异常都会促使胰腺癌的形成,并为胰腺癌细胞排挤健康细胞提供优势。
纳武单抗治疗黑色素瘤Ⅲ期临床试验效果优于依匹单抗
▲ Opdivo
7月6日,百时美施贵宝宣布,一项评估纳武单抗(Opdivo,Nivolumab)治疗IIIb/IIIc期或IV期手术完全切除后仍有高复发风险黑色素瘤患者的Ⅲ期临床试验,在中期分析中达到主要研究终点。该试验为正在进行的III期随机双盲研究CheckMate-238,共纳入了906例黑色素瘤患者,随即分配接受每两周静脉注射3mg/kg纳武单抗,或每三周静脉注射10mg/kg依匹单抗,注射4个剂量后每隔12周进行一次治疗,直至疾病进展或毒性不可接受,最长治疗时间为一年。结果发现,与依匹单抗(Yervoy,Ipilimumab)(10mg/kg)相比,接受纳武单抗(3mg/kg)治疗的患者无进展生存期有显著改善。详细试验数据会在即将举行的医学会议上进行公布,让我们一起期待!
黑色素瘤新药binimetinib和encorafenib (COMBO450)近日申请上市

▲ Array BioPharma的首席执行官Ron Squarer先生(图片来源:Cantor Fitzgerald)
7月6日,Array公司向FDA递交了binimetinib和encorafenib (COMBO450)联合治疗由BRAF突变引起的晚期、不可切除性或转移性黑色素瘤的新药申请。该申请是基于Ⅲ期临床试验COLUMBUS的结果。COLUMBUS是一个由两部分组成的、国际、随机、开放标签的Ⅲ期临床试验,旨在评估与维罗非尼(Zelboraf,Vemurafenib)和encorafenib单独治疗相比,binimetinib和encorafenib联合治疗的安全性和有效性。试验纳入了921名BRAF V600突变、不可切除性或转移性黑色素瘤患者。第1部分结果表明,COMBO450与维罗非尼单独治疗相比,患者无进展生存期(PFS)有显著延长(14.9个月 vs 7.3个月)。第2部分研究比较了binimetinib(45mg,每日两次)和encorafenib(300mg,每日一次)组合疗法(COMBO300)与encorafenib(300mg,每日一次)的疗效。结果显示,接受COMBO300治疗的患者中位PFS值为12.9个月,而接受单剂encorafenib治疗的患者为9.2个月。安全性方面,COMBO450耐受性均良好。
百济神州启动PD-1抗体BGB-A317治疗尿路上皮癌的关键临床试验

7月6日,百济神州宣布,其在研PD-1抗体BGB-A317治疗转移性尿路上皮癌的一项关键性临床试验已经启动,并入组了首位患者。值得一提的是,该试验的主要研究者为复旦大学附属肿瘤医院叶定伟教授。这是一项单臂、多中心的II期临床试验,旨在评估BGB-A317在此前接受过治疗的、PD-L1阳性、局部晚期或转移性尿路上皮癌中国患者中的安全性和有效性,主要研究终点为由独立审查委员会评估的客观缓解率,次要研究终点为由研究者评估的客观缓解率、缓解持续时间、疾病控制率、无进展生存期、总生存期、安全性和耐受性。BGB-A317是一种人源化抗PD-1单克隆抗体,与目前获批的PD-1抗体的差异在于它是通过生物工程技术改造过的PD-1抗体,对PD-1亲和性和特异性会更高。目前,BGB-A317治疗复发或难治性经典型霍奇金淋巴瘤中国患者中的关键临床试验也在进行中。
艾滋病新药ibalizumab即将上市,可治疗多重耐药的艾滋病患者
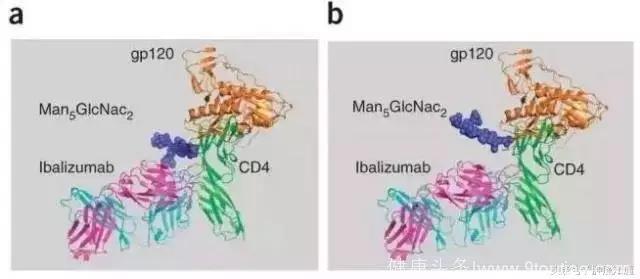
▲ Ibalizumab作用靶点示意图(图片来源:《Nature》)
近日,中裕新药宣布,FDA已接受艾滋病药物Ibalizumab治疗多重耐药人类免疫缺陷病毒-1(MDR HIV-1)的生物制剂许可申请。FDA将在2018年1月3日对该药作出批准,如果获得批准,Ibalizumab将成为近10年来首个有全新作用机制的抗逆转录病毒治疗方法,也将是首个无需每日用药的疗法。Ibalizumab于2017年5月向FDA提交了生物制剂许可申请,该申请是基于一项单臂、为期24周、有40名艾滋病患者参与的Ⅲ期临床试验TMB-301的结果,研究旨在评估Ibalizumab+优化背景疗法(OBR)对耐药性和晚期艾滋病患者的疗效。结果显示,这些患者在Ibalizumab静脉滴注治疗14天内,有82.5%的患者病毒载量显著下降。治疗24周后,有43%的患者体内检测不到HIV病毒,50%的患者体内病毒载量低于200拷贝/毫升。
GEN-1联合新辅助化疗治疗新确诊晚期卵巢癌患者最新数据公布,效果优异

▲ GEN-1是通过脂质聚合物递送系统形成纳米颗粒的IL-12 DNA质粒载体(图片来源:Celsion官网)
7月6日,Celsion公司公布了Ⅰb期剂量递增临床试验(OVATION研究)的更新数据。该公司将其IL-12基因免疫疗法GEN-1与新辅助化疗相结合,用于治疗新确诊的III期和IV期卵巢癌患者,随后进行间隔性放血手术。更新数据显示,在接受治疗的14例患者中,患者疾病控制率为100%,客观缓解率为86%,其中2例患者肿瘤完全缓解,10例患者肿瘤部分缓解,2例患者肿瘤稳定不进展。其中最高剂量组中接受治疗的5名患者达到了100%的客观缓解率,包括1名患者完全缓解,4名患者部分缓解。另外,无进展生存期(PFS)数据也有更新。在一年前接受过GEN-1治疗并且正在接受治疗的7名患者中,仅有1例患者肿瘤进展,其余6名患者平均PFS为15个月,最长为21个月。迄今为止,第三或第四剂量组的患者都没有出现疾病进展。而最新诊断为III期和IV期卵巢癌的新辅助化疗患者,间隔性放血手术后中位无进展生存期为12个月。
CFDA批准普纳布林用于预防化疗副作用的临床试验临床申请
7月6日,万春医药宣布,普那布林预防化疗引起的中性粒细胞减少症的两项Ⅱ/Ⅲ期临床试验(105和106)申请获中国食品药品监管总局(CFDA)批准。该临床试验预计在全球内招募约370名化疗患者,其中105试验190人(Ⅱ期40人,Ⅲ期150人),106试验180人(Ⅱ期60人,Ⅲ期120人),而且一半以上的患者将会是中国人。值得一提的是,该临床试验在今年1月和5月已获美国FDA的正式批准,CFDA这是同时进行了批准,如果两项试验获得成功,将大大降低肿瘤治疗的主要副作用-中性粒细胞减少症。普那布林是一种小分子抗癌药物,比现有药物G-CSF效果更好,更便捷,同时安全性也更高。万春医药计划在2017年下半年获取Ⅱ期试验的有效性数据,2018年上半年获取Ⅲ期试验的中期数据。2019年同时在美国和中国提交新药申请。
《自然》杂志发表个性化肿瘤疫苗成功治疗黑色素瘤
7月6日,美国达纳-法伯癌症研究所Wu教授团队和德国缅因兹大学Ugur Sahin团队分别宣布了两项I期临床试验结果,针对不同肿瘤突变定制的个性化肿瘤疫苗,在黑色素瘤患者治疗中大获成功!Wu教授团队的临床试验结果显示,接种疫苗的6名黑色素瘤患者中,4人肿瘤完全消失,且32个月内无复发!另外2人肿瘤仍然存在,在接受辅助治疗后肿瘤也完全消失。而gur Sahin团队的结果显示,在13位接种疫苗的患者中,8人肿瘤完全消失且23月内无复发,其余5名患者由于接种疫苗时肿瘤已经扩散,有2人出现肿瘤缩小,其中1人接受辅助治疗后肿瘤完全消退!这是首次在临床试验中取得成功的癌症疫苗研究报道!两组团队的研究成果同时发表在 7月5日的《Nature》上!











