作者:郑于臻 博士 福建省肿瘤医院胸外科(作者微信:zhengyuzhendyl)本文来自:郑正有词

长久以来,肺癌的标准治疗就是肺叶切除配合系统淋巴结清扫术(包括肺内淋巴结清扫与纵隔淋巴结清扫)。
上世纪90年代以来,随着循证医学的普及,有一部分学者开展了一系列针对肺癌的淋巴结分布规律的研究。其中比较有名的是Okada等学者开展的回顾性研究,其总结了760肺癌的淋巴结发现,在406名上叶肿瘤患者中,没有隆突水平以下淋巴结转移的病例,而在下叶肿瘤患者中,也只有1例出现了跳跃性的上纵隔淋巴结转移。而后续的一系列研究也发现了相似的现象,即上叶肺癌更倾向于转移至上纵隔淋巴结,下叶肺癌更倾向于转移至隆突水平以下的下纵隔淋巴结。基于这些现象,人们逐渐开始思考基于肿瘤部位的选择性纵隔淋巴结清扫的可行性与合理性。
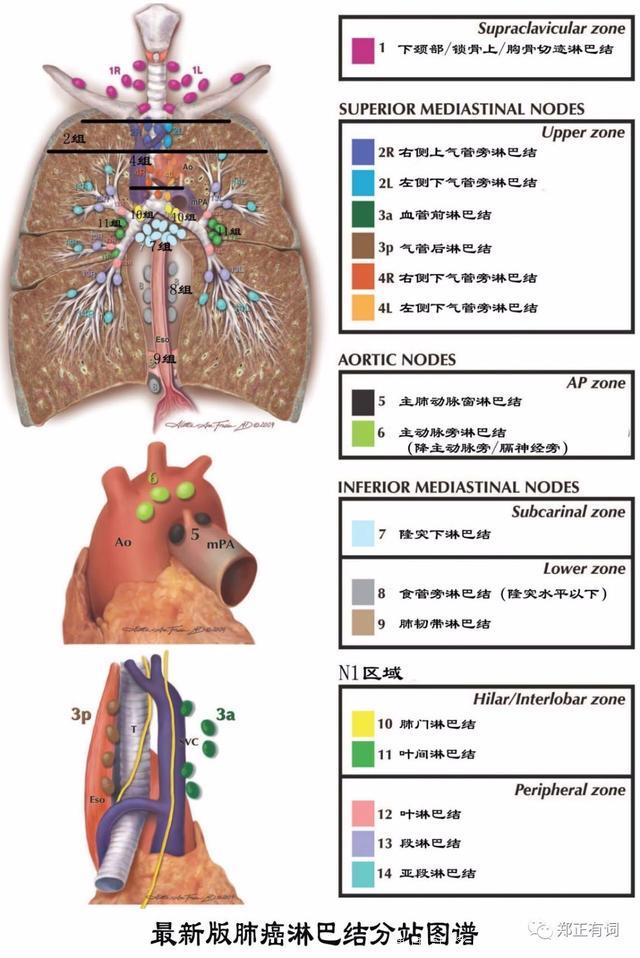
系统性纵隔淋巴结清扫范围:
右肺癌——2R/4R/7/8/9
左肺癌——4L/5/6/7/8/9
选择性纵隔淋巴结清扫范围:
上叶:右侧-2R/4R;左侧-4L/5/6
(不清扫7/8/9)
下叶:7/8/9(不清扫上纵隔淋巴结)
三、选择性纵隔淋巴结清扫的临床应用。值得注意的是,在1996年发现淋巴结转移规律之后,Okada等学者马上就开展了一项前瞻性的临床研究来验证他们的猜测(这效率真是高~~!!佩服佩服!!)。
在1997-2002年期间,在他们中心一共纳入了735名临床评估I期的非小细胞肺癌患者,分析选择性纵隔淋巴结清扫的可行性,研究结果发表在2006年的<the Annals of Thoracic Surgery>上。此次研究中,选择性纵隔淋巴结清扫的标准是:
对下叶肿瘤,且无肺门及下纵隔淋巴结转移者,保留上纵隔淋巴结不清扫。
对上叶肿瘤,且无肺门及上纵隔淋巴结转移这,保留下纵隔淋巴结不清扫。
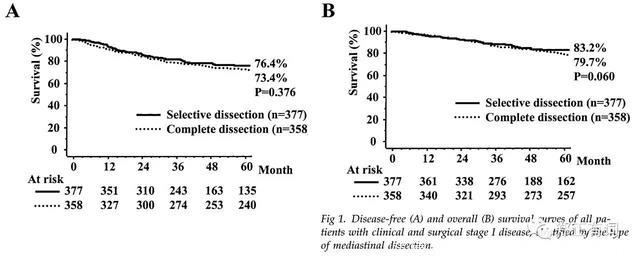
最终,纳入总患者树735例,其中有377例接收选择性纵隔淋巴结清扫,而358例则接收了系统性淋巴结清扫。
分析显示,两组患者的临床病理因素并无显著差异,生存曲线图显示,两组患者在DFS和OS方面均无明显差异(p=0.376,p=0.060)。多因素分析显示,清扫方式本身并不会对DFS以及OS造成显著影响。
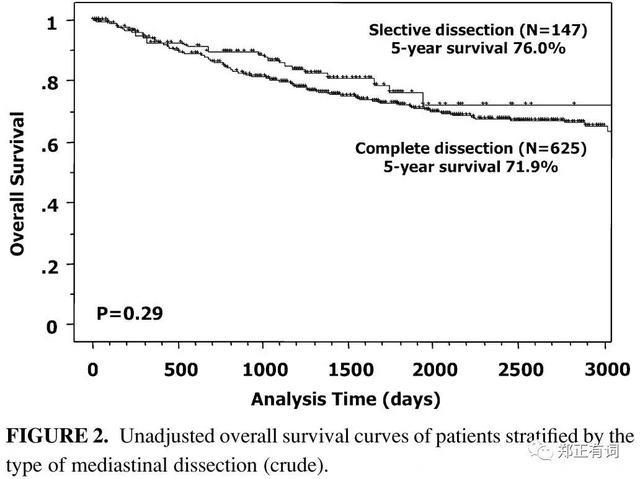
2010年,Ishiguro等学者在<Journal of Thoracic Cardiovascular Surgery>发表了一项回顾性研究,纳入了1995-2003年期间接收根治性手术治疗的893名非小细胞肺癌患者,其中625名接收系统性纵隔淋巴结清扫,而147名接收选择性纵隔淋巴结清扫。分析显示,两组患者的预后并无显著差异。即便在利用倾向性评分进行分层之后,生存分析结果仍无明显差异。
2013年,在胸科殿堂级刊物<Chest>上刊登了一篇针对选择性淋巴结清扫的报道。其回顾性分析2004-2011年期间的370例临床评估N2(-)的早期肺癌患者,228接收系统性纵隔淋巴结清扫,而88接收选择性纵隔淋巴结清扫。
通过分析淋巴结分布情况后发现,接收系统性淋巴结清扫的282名患者中,只有15名患者出现纵隔淋巴结转移,其中只有1名表现出超范围的跳跃性淋巴结转移(上叶转移到下纵隔)。生存分析显示,选择性淋巴结清扫并不会对无疾病生存乃至总生存造成不良影响。作者指出,完善、准确的术前评估对开展选择性纵隔淋巴结清扫至关重要,既往研究中临床评估N2(-)的患者中仍有20%-25%的几率出现纵隔淋巴结转移,这可能与未开展PET/CT术前评估有关。
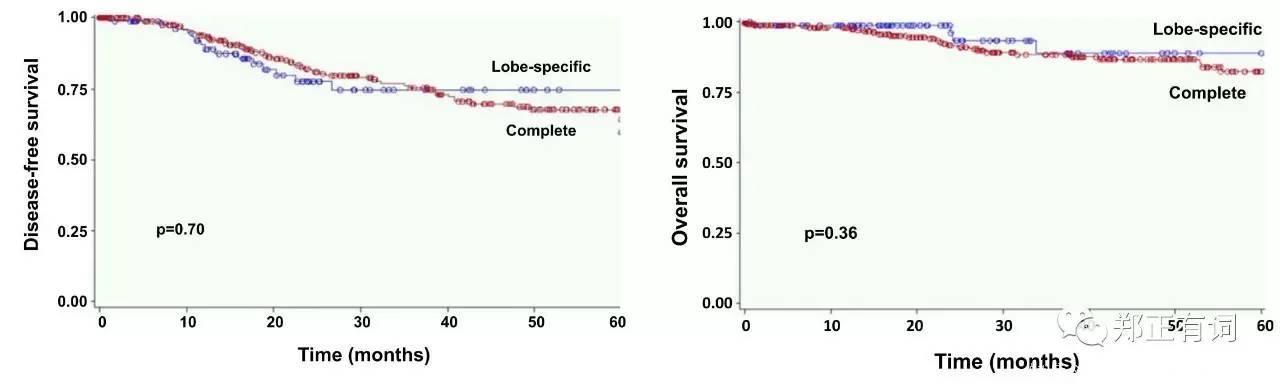
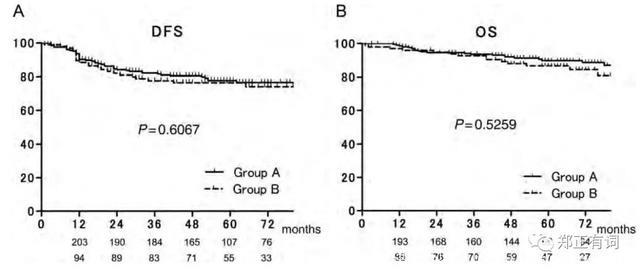
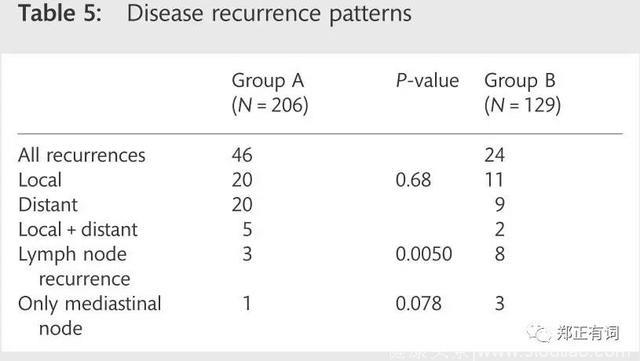
同年,Maniwa等学者在<European Journal of Cardio-Thoracic Surgery>上发表了另一项回顾性研究,纳入335名临床评估无淋巴结转移的患者开展根治性手术。研究中开展积极的术中冰冻,只有对上纵隔及肺门淋巴结阴性的上叶肿瘤患者、下纵隔及肺门淋巴结阴性的下叶肿瘤患者,选择性淋巴结清扫才被认为可选择。最终,206接收系统性淋巴结清扫(group A),而129接收选择性淋巴结清扫,在这部分患者中,98名是因为患者自身因素接收选择性清扫(妥协性清扫,group B)而31名则是因为肿瘤本身因素接收选择性清扫(意向性清扫,group C)。生存分析显示,C组的患者5年DFS和OS均为100%;而A组和B组患者的5年DFS和OS方面均无显著差异。
2010年,日本肺癌联合委员会开展了一项全国范围性的活动,收集了2004年在全国253个医疗中心因为肺癌接收手术治疗的11663名患者的临床、病理、手术以及生存资料。为了进一步确定选择性淋巴结清扫的应用价值,Hishida等学者基于此数据库开展了一项研究,发表在2016年<Journal of Thoracic Cardiovascular Surgery>上。
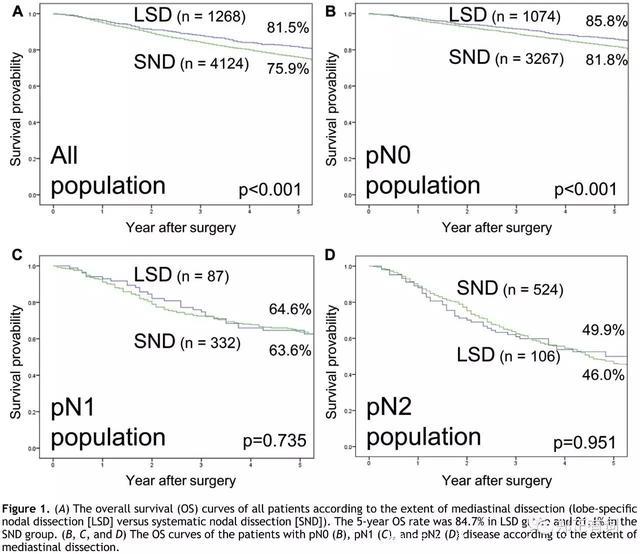
选出5392个临床I-II期的非小细胞肺癌,所有患者接收选择性纵隔淋巴结清扫(lobe-specific dissection, LSD)或系统性淋巴结清扫(systematic node dissection, SND)。最终,有1268名患者接收LSD,而4124名患者接收SND。
比较发现,选择性清扫组,更多的上叶癌、更多的早期肺癌以及更多的术后辅助化疗;而系统性清扫组,更多的术前CEA增高。病理N2的比例,在系统性清扫组比例也会更高(12.7% vs 8.4%)。分析显示,LSD患者表现出相比SND而言更好的总生存;亚组分析显示,即便在N1/N2组人群中,LSD组也表现出与SND相近的治疗效果。
当对两组患者的基础变量进行匹配而后进行生存分析仍显示出选择性清扫组较好的预后。
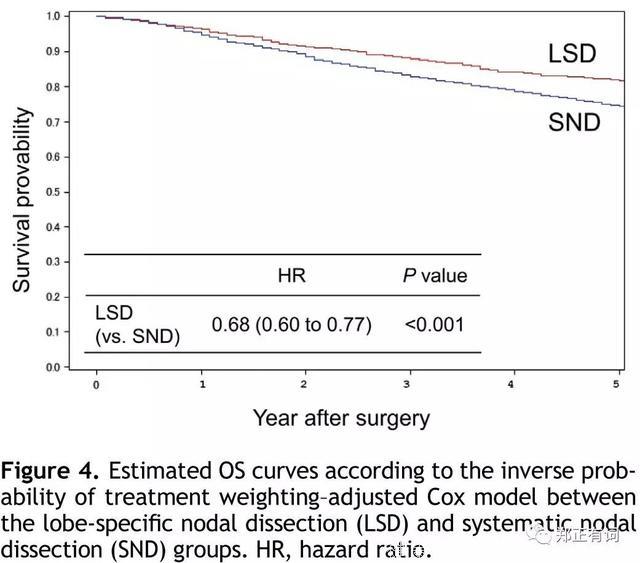
文章指出,选择性淋巴结清扫的较好的预后主要来自于选择偏倚,因为有一部分的SND是术中接收了冰冻后从LSD转过去的。尽管该研究存在一定的偏倚,但至少暗示,在一部分早期患者中开展选择性纵隔淋巴结清扫可以实现较好的疾病控制率。
四、反对声音。针对选择性纵隔淋巴结清扫的兴起,有少部分的学者提出了质疑。2016年,<the Annals of Thoracic Surgery>刊登了一篇来自日本的研究。Eckardt等学者通过回顾性分析5577例接收系统性纵隔淋巴结清扫的肺癌患者的临床资料后指出,基于以下三点考虑,应对所有肺癌患者施行隆突下淋巴结清扫,而不应该过分推崇选择性纵隔淋巴结清扫。
1. 在Danish开展的回顾性分析中,接收肺叶切除的肺癌患者中,有接近36%的临床T1患者会出现病理升期的情况(即从T1升至T2/T3/T4),因此这部分患者中隆突下淋巴结转移几率会比较高;
2. 隆突下淋巴结清扫本身,对熟练的胸外科医师而言,是一项简单易行的操作,并不会带来显著增高的手术风险和术后并发症;
3. 最重要的是,已有研究证明,接收选择性淋巴结清扫的患者复发率较系统性淋巴结清扫的复发率较高(EJCTS,2013)。
结合文献报道相关结果,郑医生觉得这种解释似乎有点牵强,尤其在选择性淋巴结清扫复发率较高方面。因为其一,既往关于两种手术方法的DFS方面的比较均未看见明显的差异;其二,EJCTS 2013年的那篇报道中,也就是前文提到的Maniwa的研究,206接收系统性淋巴结清扫(group A),而129接收选择性淋巴结清扫,在这部分患者中,98名是因为患者自身因素接收选择性清扫(妥协性清扫,group B)而31名则是因为肿瘤本身因素接收选择性清扫(意向性清扫,group C)。生存分析显示,C组的患者5年DFS和OS均为100%;而A组和B组患者的5年DFS和OS方面均无显著差异。复发率较高的结论是来自A组和B组的比较,但是这种比较在纳入方面本身就存在一定的问题,因为B组的患者是妥协性的清扫;此时如果纳入C组患者,那么是不是可以解读成选择性清扫患者不会发生复发呢?
总结既往文献以及近年来相关报道,郑医生认为,在特定肺癌人群中开展选择性纵隔淋巴结清扫,可以达到和系统性纵隔淋巴结清扫相近的治疗效果,因此,有其合理性。
目前主要的争议在于选取何种患者开展此类手术?结合既往文献以及自身认识,郑医生认为,对于cT1、PET/CT提示未见纵隔淋巴结转移以及术中冰冻确定肺门即特定区域纵隔淋巴结无转移(上叶肿瘤则上纵隔、下叶肿瘤则下纵隔)的患者,开展选择性纵隔淋巴结清扫应该是可以保证治疗效果的。
选择性纵隔淋巴结清扫的证据坐实还有赖于RCT的开展,为此,郑医生以“lung cancer”&"lymphadenectomy"检索了ClinicalTrial.gov,发现目前运行的临床研究一共11项,但均无针对选择性纵隔淋巴结清扫所开展,因此,选择性纵隔淋巴结清扫的大规模应用、甚至写入治疗指南仍需较长时日。

迄今为止,郑医生所了解的选择性纵隔淋巴结清扫的文章皆来自于日本学者。作为一种在可能产生“伦理争议”的手术方式,日本学者在1996年刚发现淋巴结转移现象之后就在1997年就开展了针对该问题的前瞻性研究,就此,郑医生除了佩服其行政部门的高效之外,还有一个小小的疑惑,日本的医疗环境当真好到能让医学行为的开展如此“唯证据是从”么?
本文审阅:
参考文献
1. Okada M, Sakamoto T, Yuki T, et al.Selective mediastinal lymphadenectomy for clinico-surgical stage I non-smallcell lung cancer. Ann Thorac Surg2006;81:1028-32.
2. Shapiro M, Kadakia S, Lim J, et al.Lobe-specific mediastinal nodal dissection is sufficient during lobectomy byvideo-assisted thoracic surgery or thoracotomy for early-stage lung cancer. Chest 2013;144:1615-21.
3. Maniwa T, Okumura T, Isaka M, et al.Recurrence of mediastinal node cancer after lobe-specific systematic nodaldissection for non-small-cell lung cancer. EurJ Cardiothorac Surg 2013;44:e59-64.
4. Ishiguro F, Matsuo K, Fukui T, et al.Effect of selective lymph node dissection based on patterns of lobe-specificlymph node metastases on patient outcome in patients with resectable non-smallcell lung cancer: a large-scale retrospective cohort study applying apropensity score. J Thorac CardiovascSurg 2010;139:1001-6.
5. Hishida T, Miyaoka E, Yokoi K, et al.Lobe-Specific Nodal Dissection for Clinical Stage I and II NSCLC: JapaneseMulti-Institutional Retrospective Study Using a Propensity Score Analysis. J Thorac Oncol 2016;11:1529-37.
6. Eckardt J, Jakobsen E and Licht PB.Subcarinal Lymph Nodes Should be Dissected in All Lobectomies for Non-SmallCell Lung Cancer-Regardless of Primary Tumor Location. Ann Thorac Surg 2017;103:1121-5.