脂肪肝是指由于各种原因引起的肝细胞内脂肪堆积过多的病变,是一种常见的临床现象,而非一种独立的疾病,其临床表现轻者无症状,重者病情凶猛。一般而言,脂肪肝属可逆性疾病,早期诊断并及时治疗常可恢复正常。脂肪肝是肝癌和肝硬化的一个重要的危险因素,而据报道,全球患脂肪肝的人数达到30%。研究人员表示,DHA膳食中的脂肪酸虽然不能治愈脂肪肝,但是却可以阻止脂肪肝的进一步恶化。
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是指与饮酒、肝炎病毒等无关的因素所引起的肝脏中甘油三酯与脂肪酸的过度堆积,在中国普通人群中发病率超过20%。其中,在肥胖、糖尿病等胰岛素抵抗人群中高达75%,且可由单纯性肝脏脂肪变性与脂肪性肝炎发展到肝纤维化和硬化甚至肝癌,严重威胁国人的健康。
根据美国肝脏基金会,NAFLD是一个起始于过量脂肪堆积于肝脏的连续疾病。随着疾病进展,纤维化会增加,这可能会导致肝硬化——一种永久的瘢痕,会导致肝脏衰竭,需要肝脏移植。在美国,NAFLD影响着3000万人,其中约10%为儿童,诊断出NAFLD的平均年龄为12岁。
NAFLD的病因比较复杂,目前临床上认为肥胖、糖尿病、长期使用激素、不当的饮食与生活方式以及锻炼不足等均是其致病原因,但对其发病具体机制仍缺乏了解,对应的治疗手段非常有限。基于此,小编针对近年来脂肪肝(尤其是NAFLD)研究取得的进展进行一番盘点,以飨读者。
1.脂肪肝会导致致命的肝硬化和肝癌吗?如何避免?
doi:10.1371/journal.pone.0173376

一项新的研究表明,omega-3脂肪酸的一种可以保护肥胖或者饮食不良人群的肝损伤。来自俄勒冈州立大学的研究人员表示,在发达国家,很多人减肥失败。在DHA膳食补充中,有一种omega-3脂肪酸可以阻止酒精肝的发展,预防肝硬化和肝癌的形成。
在十年的随访中,由于肝癌和肝硬化的死亡率分别为20%和12%。研究人员发现,这些人群体内omega-3脂肪酸的含量非常低,那么如果加入这一成分,是否可以阻止这一疾病发展呢?
omega-3脂肪酸可以调节正常的生物学途径,包括脂肪酸合成,氧化,甘油三酯或血液的分解,除此之外,它还是肝修复的重要成分。DHA含量最高的食物为油性鱼类如鲑鱼,鲭鱼,金枪鱼,沙丁鱼,除此之外,还要诸如家禽、肝脏、蛋黄、和某些类型的藻类中也能找到。
除了饮食之外,健康的生活方式和锻炼加以配合的话,完全逆转肝损伤也是有可能的。研究人员表示,DHA是现成安全的补充剂,可以放心使用。
2.肠道细菌激活T淋巴细胞引起脂肪肝
doi:10.1126/sciimmunol.aan1473
肥胖可诱发心血管疾病、癌症和 2 型糖尿病等一系列疾病,也已经成为流行性健康风险因素。肥胖患者脂肪积累在肝脏,逐渐形成非酒精性脂肪肝病,发生胰岛素抵抗。Ghazarian 等最近在《科学免疫学》发表最新研究,证明非酒精性脂肪肝患者的胰岛素抵抗和肥胖小鼠模型肝脏内 CD8 + T 细胞激活是非常重要的病理生理过程。另外发现,肠道微生物在激活肝脏内 CD8 + T 细胞过程中也扮演重要角色,这一研究为代谢性疾病的预防和治疗提供了新的视角。
最新在《科学免疫学》杂志上,多伦多大学 Ghazarian 等的研究发现,一型干扰素介导的炎症反应可激活肝脏内 CD8 阳性 T 淋巴细胞,这会导致脂肪肝患者和小鼠全身葡萄糖代谢紊乱。 研究使用高脂饮食小鼠、瘦素缺乏(ob/ob)小鼠和人类脂肪肝患者样本,发现人类和动物脂肪肝组织内存在 CD8 阳性 T 淋巴细胞特异性激活。和正常饮食动物不同,高脂饮食小鼠肝脏 CD8 阳性 T 淋巴细胞特异性激活,并可以产生干扰素和肿瘤坏死因子,导致胰岛素抵抗。瘦素缺乏(ob/ob)小鼠和人类患者也存在类似的病理改变。选择性阻断高脂饮食小鼠 CD8 阳性 T 淋巴细胞干扰素 I 信号能避免细胞激活,并可以提供胰岛素敏感性。使用光谱抗生素杀死肠道细菌,也可以降低干扰素水平和肝脏内 CD8 阳性 T 淋巴细胞数量。根据上述研究结果,Ghazarian 等提出来自肠道菌的代谢产物或分解产物启动了肝脏干扰素信号系统,激活了肝脏内 CD8 阳性 T 淋巴细胞,最终导致肝脏为中心的代谢紊乱。
本研究和过去研究发现,脂肪肝肝脏组织内存在 CD4 和 CD8 阳性 T 淋巴细胞激活,但是仍然没有完全回答全部问题,例如这些细胞到底如何被激活。理论上应该存在能激活这些淋巴细胞的特异性抗原,本研究中作者分析了肝脏内 CD8 阳性 T 淋巴细胞 T 细胞受体,但是并没有发现脂肪肝组织内有明显不同。作者认为这种 T 细胞激活是非 T 细胞受体依赖的过程,可能是炎症因子旁路激活通路。虽然这种旁路假说没有先例,这些数据提示存在这种可能。固有淋巴细胞如先天淋巴细胞、自然杀伤 (NK) 细胞和自然杀伤 T 细胞 (NKT) 都可以快速响应细胞因子。如果 NK 细胞和先天淋巴细胞也存在于肝脏组织内,难以理解的是为什么 CD8 阳性 T 淋巴细胞会执行这种本来属于固有免疫细胞的功能。另外也不是所有肝脏内 CD8 阳性 T 淋巴细胞都是传统的 CD8 阳性 T 淋巴细胞,例如人类肝脏内就存在许多(20-50%)粘膜相关不变 T 细胞也是 CD8 阳性,这种细胞属于固有免疫淋巴细胞,能识别细菌代谢产物。虽然作者声称 CD8 阳性 T 淋巴细胞是不依赖抗原,这种说法虽然新颖但要小心。
最新研究支持肥胖相关肠道菌群、慢性炎症和胰岛素抵抗之间的相互关系,口服光谱抗生素清除细菌后虽然能阻断肝脏炎症反应和胰岛素抵抗,但是并不能降低动物体重,这提示肥胖和炎症存在独立的病理过程。肠道菌群对免疫功能调节影响脂肪肝等代谢性疾病的现象被反复验证。许多研究对肠道菌进行宏基因分析,Rabot 等的研究发现高脂饮食动物肠道内拟杆菌门能保护动物发生胰岛素抵抗,厚壁菌门则具有相反的作用。是否这些细菌也能调节干扰素的水平和 CD8 阳性细胞的激活,这非常值得深入研究。对引起这些作用的细菌成分也需要进一步确认。当然也不能排除细菌在维生素合成、多糖发酵、短链脂肪酸和胆汁酸代谢等方面的作用。曾经有报道发现,高脂饮食动物由于梭状芽胞杆菌增加造成脱氧胆酸、二次胆汁酸等细菌代谢产物增加。
3.Lipids Health Dis:食用原生橄榄油的好处有哪些?
doi:10.1186/s12944-017-0450-5

最近一项小鼠水平的研究结果表明,原生橄榄油中的一类提取物能够缓解高脂饮食的一些负面效应。通过向小鼠饲喂高脂饮食,研究者们发现这种叫做羟基酪醇的化合物能够扭转胰岛素抵抗性以及非酒精型脂肪肝疾病的部分生物标记。
该项研究的首席作者,来自智利大学的研究者Rodrigo Valenzuel博士认为:“羟基酪醇是一种从原生橄榄油中提取得到的多酚类物质,这种物质具有抗氧化活性,对于促进身体健康具有重要的作用。我们的研究表明,通过向小鼠饲喂高脂饮食,羟基酪醇能够起到一定的保护肝脏的效应”。
研究者们此前希望找到羟基酪醇对肝脏特异性的酶类物质(即催化长链不饱和脂肪酸合成的酶类)的相关效应。饲喂高脂饲料的小鼠相比对照小鼠其肝脏中酶的水平有明显下降,这进一步引起了肝脏、大脑以及心脏脂肪酸水平的失衡。然而,同时接受羟基酪醇治疗的小鼠则表现出明显升高的肝脏活性,几乎与饲喂正常饲料的小鼠一致。
作者们将小鼠分为四组,分别饲喂高脂饲料与普通饲料,同时分别接受羟基酪醇治疗或对照处理。通过十二周的处理,作者们检测了这些小鼠体内血液与组织的样本,并分析了这些处理对小鼠饮食消化能力、氧化压、脂肪酸构成以及多器官酶活性的影响。结果显示,接受高脂饲料的小鼠体内低密度脂蛋白的水平与明显升高,而高密度脂蛋白的水平则没有明显变化,而这一现象在接受了羟基酪醇刺激之后得到了明显的缓解。
4.J Pediatr:孩子出生体重太轻或太重都可能意味着脂肪肝风险!
doi:10.1016/j.jpeds.2017.03.007
来自加州圣地亚哥分校(UCSD)医学院的研究人员与美国的一组医学研究者一起合作发现了出生体重轻重对孩子患非酒精性脂肪肝(NAFLD)的影响,NAFLD是一种慢性疾病,通常需要器官移植。这项研究的结果发表在Journal of Pediatrics上。
“我们的研究发现婴儿出生体重过重或者过轻都与严重的肝脏疾病有关,但是影响方式不一样。”UCSD医学院小儿科教授、圣地亚哥雷迪儿童医院脂肪肝诊所主任Jeffrey Schwimmer博士说道,“出生体重轻的儿童更可能产生严重的肝脏瘢痕,而出生体重较重的儿童更可能由脂肪肝发展成为肝炎。”
在生命早期,低出生体重和高出生体重就预示着孩子健康相关疾病风险增加,其中之一就是NAFLD。出生体重涉及产妇和子宫内因素,对婴儿肝脏健康可能有长期影响。
Schwimmer指出早期研究表明出生体重较轻和心血管疾病及糖尿病相关。但是迄今为止还没有研究揭示较重的出生体重和长期健康问题之间的关系。
“这是首个表明极端出生体重(较轻或者较重)都与NAFLD风险增加相关的研究。”Schwimmer说道,“为了防止婴儿患肥胖症、肝脏疾病和糖尿病,这些出生体重较轻或者较重的婴儿都值得关注。”
5.研究发现pNaKtide可以减弱实验性非酒精性脂肪肝和动脉粥样硬化
doi:10.1038/s41598-017-00306-5
马歇尔大学Joan C. Edwards医学院研究人员发现,pNaKtide这种多肽可用于阻断细胞内钠钾泵的氧化剂增强功能,并成功地证明了pNaKtide可以减弱实验性非酒精性脂肪肝(NAFLD)和动脉粥样硬化。研究结果发表在3月15号的《Scientific Reports》杂志上,这是《Nature》的一个在线期刊。
"pNaKtide是由马歇尔跨学科研究所(MIIR)主任Zijian Xie博士,以及托莱多大学的Jiang Tian博士和我自己研发的一种多肽,我们给两种小鼠喂食典型的西方饮食--高脂肪和果糖。结果表明pNaKtide对于缓解与典型西方饮食相关的NAFLD和动脉粥样硬化非常有效。如果这种多肽最终能被开发成药物,可能对本地区特有的疾病过程具有实质性的作用。"医学院院长和出版物的资深作者Joseph I. Shapiro博士说到。
研究人员注意到C57B16小鼠模型中胰岛素敏感性增加,血脂异常,主动脉条纹和体重增加。此外,低密度脂蛋白(坏胆固醇)显着降低而高脂密度脂蛋白(好胆固醇)浓度增加。在动脉粥样硬化快速进展的ApoE基因敲除小鼠中,也观察到同样的变化,并且与动脉粥样硬化显着减少有关。
6.Hepatology:TRIM8通过泛素化调控TAK1加剧胰岛素耐受及脂肪肝病症
doi:10.1002/hep.28971
早期的研究显示,具有E3泛素连接酶活性的TRIM8及其TRIM家族成员通过调节炎症反应来影响肿瘤和免疫疾病的进程。而由于炎症反应也与非酒精性脂肪肝(NASH)密切相关,因此科研人员猜测TRIM8还可能调控NASH的进程。为了验证该假设,他们对临床样本及动物模型中的TRIM8表达量进行了检测,发现在脂肪沉积及脂肪肝病人样本中TRIM8有明显上调,这种差异表达也同时在应激胁迫及基因缺陷的小鼠模型中被检测到。
为了寻找TRIM8与NASH的病理过程更深层次的相关性,研究人员构建了只有肝细胞中特异性过表达TRIM8的小鼠模型(TRIM8-HTG),在多脂饮食(HFD)条件下,TRIM8-HTG小鼠的体重、血糖、胰岛素水平都有显著上调,另一方面,胰岛素抵抗指数HOMA-IR明显随TRIM8的上调而增加,胰岛素信号通路的关键分子IRSTry608,?AKTSer473, and GSK3β的磷酸化水平同时受到影响而下调。这些数据证实TRIM8会加剧HFD胁迫下的胰岛素耐受和血糖代谢紊乱。相反的,对于只有肝细胞中特异性缺失TRIM8的小鼠(TRIM8-HKO),HFD引起的胰岛素耐受症状得到了显著的缓解,从另一个角度证明了TRIM8与NASH病理过程的联系。
越来越多的证据表明,丝裂原活化蛋白激酶MAPK信号通路分子对NASH的发生发展有重要影响。研究人员发现,JNK/p38信号通路中的一个重要成员--转化生长因子激酶1(TAK1)的磷酸化水平随TRIM8的过表达而显著上调,而如果在小鼠模型中特异性抑制TAK1的磷酸化激活,与TRIM8相关的胰岛素耐受、血糖上升、代谢紊乱等症状都会得到大幅缓解,暗示TAK1是受TRIM8调控的一个重要的下游分子。为了确证这种调控作用,研究人员在体内和体外试验中分别证明TAK1和TRIM8存在互作。TRIM8具有E3连接酶活性,而TAK1的磷酸化水平被报道与其泛素化水平相关,由此研究人员进一步证明了TAK1的磷酸化激活和下游信号受到TRIM8介导的泛素化调控,同时TRIM8与TAK1的互作和泛素化调控也对HFD引起的胰岛素耐受和NASH病程产生影响。
7.那些常见食物或土壤中的抗氧化剂可以防止肝脏疾病
doi:10.1096/fj.201600906R
根据科罗拉多大学Anschutz医学院的研究人员,在人类母乳和猕猴桃等食物中常见的抗氧化剂可以防止肥胖小鼠后代的非酒精性脂肪性肝病(NAFLD)。
该研究的主要作者麻醉学副教授和CU Anschutz的物理学家Karen Jonscher博士说,“吡咯喹啉醌或PQQ是一种在土壤和许多食物中发现的天然抗氧化剂。“当在怀孕和哺乳期给予肥胖小鼠母亲时,我们发现可保护他们的后代不发展肝脂肪。
上周这项研究在美国实验生物学会联合会杂志上发表,是第一个证明PQQ可以保护肥胖母亲的后代免于肥胖引起的肝脏疾病的研究。
Jonscher和她的同事以健康饮食或西方风格的饮食,重脂肪,糖和胆固醇喂养成年小鼠。它们的后代在母亲如此饮食中饲养20周。喂养西方饮食的比健康饮食的获得更多的体重。PQQ虽没有改变体重的增加,但它确实减少了肝脏中的脂肪。
抗氧化剂还减少了喂养西方饮食的小鼠的肝脏中的炎症。研究人员发现,即使当小鼠放弃母乳喂养三个星期后,PQQ也可保护成年小鼠免受脂肪肝影响。Jonscher认为,抗氧化剂可能对母亲的肥胖,高脂肪饮食和炎症相关的疾病起作用。
Jonscher说,它可能用作产前或哺乳期的补充剂,以保护肥胖母亲的儿童在成年期不会患肝脏和心血管疾病,但孕妇在服用任何补充剂之前应该咨询医生。
8.中国科学家探明非酒精性脂肪肝发病机理
doi:10.1002/hep.28747
合肥工业大学14日透露,该校科研团队和美国科研机构合作,探明了“非酒精性脂肪肝”发病机理,发现了新的调控肝脏脂肪化基因。这一在细胞与分子水平上的最新研究成果,刊登在肝脏研究领域国际著名期刊《肝脏学》上。
合肥工业大学长江学者特聘教授韩际宏课题组与美国威斯康辛医学院合作开展的研究,发现了新的调控肝脏脂肪化的基因Nogo-B蛋白受体(又称NgBR)。该项研究发现,肝脏中NgBR蛋白水平降低与脂肪肝发病有直接关系。
在相关实验中,敲除NgBR基因的小鼠肝脏中积累了大量甘油三酯与自由脂肪酸。研究证实,这种脂肪的积累是由于NgBR水平下降密切相关。据介绍,因NgBR水平下降导致调控肝脏脂肪酸合成的中枢分子肝X受体alpha的核转移与激活,同时与具有增强体内能量代谢传感器功能的腺苷酸活化蛋白激酶alpha失活密切相关。
据介绍,目前临床上用于降胆固醇的他汀类药物也具有一定的抗“非酒精性脂肪肝”功能,但由于机制尚未探明,影响其实际应用。相关研究结果表明,调控NgBR水平是防治非酒精性脂肪肝的有效手段之一,而他汀类药物可以通过刺激肝脏NgBR水平,抑制其发生与发展。
9.Cell:重大突破!新分子有效清除肝脏和血液中的脂肪
doi:10.1016/j.cell.2016.09.014
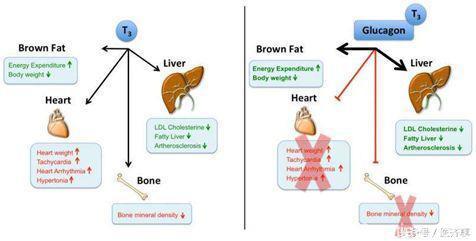
慕尼黑工业大学(Technische Universität München)的科学家开发出一种“智能”药物,该药物可安全有效地清除肝脏脂肪并预防血栓。其工作原理类似于特洛伊木马,通过一个巧妙的方法把药物进入到肝脏。具体来说,就是利用胰高血糖素作为载体,把甲状腺激素T3准确地送至肝脏内,同时避开其他器官。这样既可以改善胆固醇和脂质代谢,又避免了甲状腺激素的副作用。 由新陈代谢学专家Matthias Tschöp(亥姆霍兹慕尼黑中心/慕尼黑工业大学),Richard diMarchi(印第安纳州立大学,Indiana University)及Timo Müller(亥姆霍兹慕尼黑中心)率领的国际研究团队,在发表于《细胞》(Cell)杂志上的论文中介绍了这项研究。该研究利用胰高血糖素作为载体将甲状腺激素T3定点输运到肝脏中,以治疗肥胖、葡萄糖不耐症、脂肪肝和动脉粥样硬化,并避免了治疗所带来的副作用。“T3降低胆固醇的作用早已为人熟知,但是它的副作用,尤其是对骨骼和心血管系统的影响,严重限制了其药用价值,”文章的第一作者,Brian Finan介绍到。
“我们采用的部分策略是利用胰高血糖素作为载体,将甲状腺激素运送到只携带胰高血糖素受体的细胞内,”曾负责过多项重要实验项目的Christoffer Clemmensen说道,他解释说:“由于肝脏中含有大量的胰高血糖素受体,而心脏和骨骼中几乎没有,我们构建的分子可以将甲状腺激素集中在肝脏,远离其他可能会造成损害的器官。”“接下来的任务将考察该药物在临床研究中是否仍然对目标组织具有选择性。” diMarchi介绍到。“如果在人体中同样安全有效,那么这种特殊的“智能”药物可能真的会为开发更加精准的代谢药物提供新思路。”Tschöp总结说。
10.研究发现高蛋白饮食有助改善糖尿病患者的脂肪肝
doi:10.1053/j.gastro.2016.10.007
根据德国人类营养研究所对2型糖尿病患者进行的一项最新营养学研究,他们发现高蛋白饮食能够降低肝脏脂肪含量,6周内最多可将肝脏脂肪含量减少48%。饮食究竟以植物蛋白还是动物蛋白为主并不重要。相关研究结果发表在国际学术期刊Gastroenterology上。
世界范围内多项研究已经调查过高蛋白饮食对人类代谢的影响。在许多研究中,科学家们观察到高蛋白饮食对体重,肝脏脂肪含量,血脂水平,长期血糖水平以及肌肉含量都有有益作用。但是一些研究也发现高蛋白摄入可以降低胰岛素活性,影响肾脏功能。由于不同研究既观察到高蛋白饮食的积极作用也观察到负面作用,因此德国人类营养研究所的研究人员提出问题,蛋白质来源是否是导致产生不同作用的决定因素。因此在这项研究中,他们研究了两种高蛋白饮食对37名参与者的代谢产生的影响,这些参与者年龄在49岁到78岁之间,都患有2型糖尿病,大部分人还存在脂肪肝。这两种高蛋白饮食的唯一差别是蛋白质来源(植物来源和动物来源)。
为了保证研究期间参与者们的体重能够保持稳定,研究人员为每个人调整了饮食的总热量,并随机安排参与者们选择其中一种高蛋白饮食。结果表明所有研究参与者都从高蛋白饮食中得到获益,与蛋白来源无关,并且没有观察到高蛋白饮食对肾脏功能和葡萄糖代谢的不良影响。肝脏脂肪含量下降最为显著,一半参与者下降了超过50%,与此同时研究人员还观察到参与者们的肝脏脂质代谢出现有利变化,胰岛素敏感性得到改善,血液中FGF21的水平出现了显著下降。之前有研究发现肝脏合成的FGF21能够影响包括脂肪组织在内的多个器官组织,特别是对于超重和肥胖的人来说,他们血液中的FGF21水平通常较高。
研究人员表示,还需要更大型更长期的研究来更加深入的理解其中的代谢机制以及高蛋白饮食对代谢的长期影响,同时观察年轻病人是否也能从这种饮食方式中获益。
11.JCI:新研究找到脂肪肝与2型糖尿病之间的因果关联
doi:10.1172/JCI86013
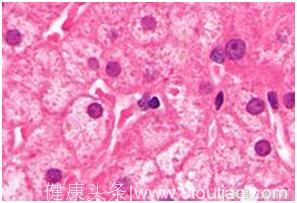
肝脏产生胰岛素抵抗是促进2型糖尿病发生的一个主要因素,而肝脏胰岛素抵抗总是与肝脏脂肪堆积过多——也就是非酒精脂肪肝存在相关性。但是非酒精脂肪肝与2型糖尿病之间是否存在因果关系一直不清楚。在最近的一些研究中,耶鲁大学医学院教授、霍华德休斯医学研究所研究员Gerald Shulman在非酒精脂肪肝疾病中发现了一些能够引起肝脏胰岛素正常功能出现偏差的因素。
在这项新研究中,Shulman和他的同事们发现胰岛素受体上一个氨基酸发生磷酸化会引起非酒精脂肪肝动物模型出现肝脏的胰岛素抵抗。“我们通过将胰岛素受体上的一个苏氨酸突变为丙氨酸,使其不能发生磷酸化证明了这个氨基酸在引起与非酒精脂肪肝相关的肝脏胰岛素抵抗方面的作用,同时还发现如何在存在脂肪肝的情况下防止肝脏胰岛素抵抗的出现。”Shulman这样说道。
这一最新发现让科学家们向着开发2型糖尿病治疗新方法方向又迈近了一步,这样可以从分子上根本解决胰岛素抵抗的成因,而目前许多抗糖尿病药物都只瞄准如何降低血糖浓度不去解决胰岛素抵抗的问题。
12.Cancer Cell:揭示触发非酒精性脂肪性肝炎和肝癌产生机制
doi:10.1016/j.ccell.2016.05.020
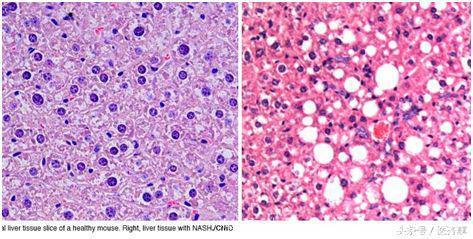
在一项新的研究中,来自西班牙国家癌症研究中心(CNIO)的研究人员证实一种促炎分子IL-17A是这种疾病产生的一种关键性因子,并且指出阻断IL-17A或利用地高辛(digoxin, 一种抗心律失常试剂)等药物抑制分泌IL-17A的细胞可能能够用于阻止容易患上肝细胞癌(HCC)的病人所患的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)。
通过研究不同的模式小鼠,研究人员证实过量的营养物如何促进肝脏中癌基因URI表达。URI---也在病毒性肝炎中上调表达---导致肝细胞发生DNA损伤,接着这触发一种系统性炎症,以及白色脂肪组织和肝脏之间的交谈,从而最终导致NASH产生。
当DNA损伤在肝细胞中出现时,免疫细胞侵入肝脏中,特别是释放促炎分子IL-17A的Th17细胞。作为一种细胞因子,IL-17A诱导嗜中性粒细胞侵入白色脂肪组织,这会导致胰岛素耐受性产生和脂肪酸释放,从而导致NASH产生。Djouder说,“2型糖尿病似乎先于NASH和HCC出现。”
研究人员也将IL-17A注射进健康小鼠体内,然后观察到NASH的初始迹象如何在4周后出现,从而证实它在这种疾病的发展中发挥着一种至关重要的作用。再者,Djouder和他的团队利用多种方法---抗体、地高辛及其其他分子---阻断IL-17A,从而阻止NASH和HCC产生。
此外,URI表达和IL-17A水平与肥胖的、HBV感染和HCV感染的病人容易患上NASH和HCC之间存在正相关性。这一发现应当为阻止高风险患者(特别是糖尿病或肝炎病毒感染患者)患上NASH和HCC制定出新的预防策略铺平道路。(医齐享 www.yqxcn.com)