导读
过去几年,非小细胞肺癌(NSCLC)的治疗取得了重大进展。随着我们对疾病生物学和肿瘤进展机制的认识的增强,小分子酪氨酸激酶抑制剂和免疫治疗的应用给肺癌患者带来了前所未有的生存益处。 然而,非小细胞肺癌的总体治愈率和生存率仍然很低,特别是在转移性疾病中。 因此,需要继续研究新药和联合治疗将临床益处扩大到更广泛的患者人群,并改善非小细胞肺癌的预后。
肺癌是世界范围内癌症死亡最常见的原因,估计每年有160万人死于肺癌。大约85%的患者为非小细胞肺癌(NSCLC),其中肺腺癌(LUAD)和肺鳞癌(LUSC)是最常见的亚型。肺癌最常见的病因是吸烟,而从未吸烟者肺癌在女性和东亚更常见,与环境暴露有关,包括二手烟、污染、致癌物以及遗传因素等。
近20年来,随着分子靶向疗法和免疫疗法的出现,NSCLC的治疗取得了巨大的进展。近日,Nature期刊上发表了一篇文章,回顾了在NSCLC领域取得的进展。
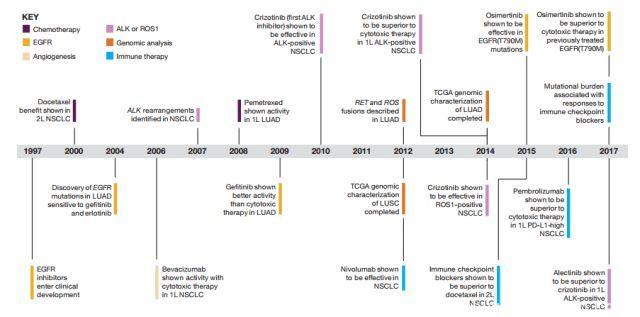
图1 NSCLC二十年治疗进展
肺癌生物学
肺癌是一种在分子水平上存在异质性的疾病,而理解肺癌的生物学机理对开发有效疗法至关重要。
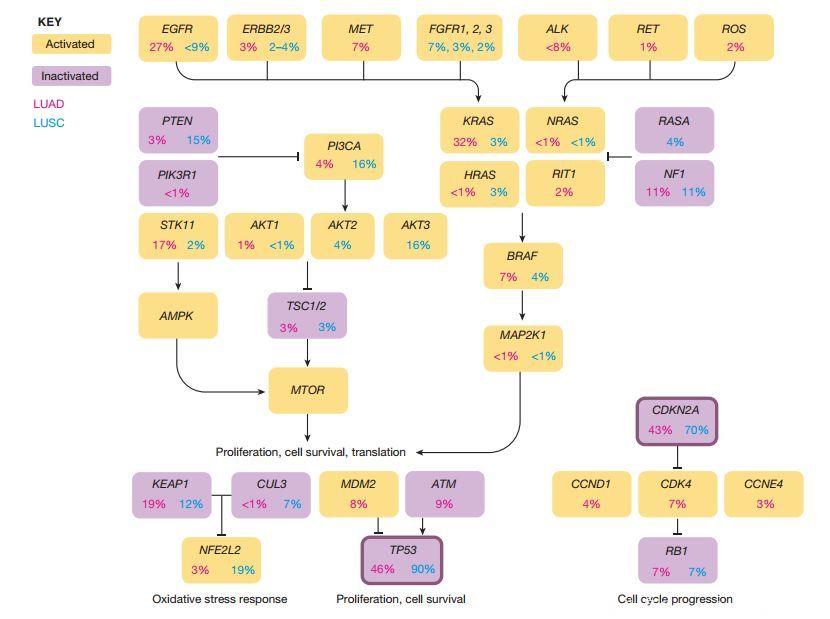
图2 非小细胞肺癌中常见的遗传突变
靶向治疗
靶向治疗的出现改变了肺癌治疗的现状,其疗效可见并为肺癌治疗带来一场革命。
EGFR
EGFR属于酪氨酸激酶受体家族,家族成员也包括人表皮生长因子受体2(HER2,也称为ERBB2),HER3(ERBB3)和HER4(ERBB4)。最常见EGFR突变与EGFR TKIs的敏感性有关,包括外显子19缺失和外显子21上的错义突变(L858R)。
第一代表皮生长因子受体酪氨酸激酶(EGFR TKIs),包括吉非替尼和厄洛替尼,与细胞毒性疗法相比,显示出更高的客观缓解率(ORR)和无进展生存(PFS)。
第二代EGFR TKIs包括阿法替尼和达克替尼,与第一代相比作用范围更广,可以靶向HER2和HER4。
EGFR-TKI的研发与广泛应用,大大地提高了肺癌EGFR突变患者的总生存期,然而EGFR-TKI在治疗后往往会出现耐药。EGFR-TKI耐药最主要的原因就是在20号外显子出现T790M点突变,该位点突变的病人比例超过耐药病人的50%。针对该耐药机制,主要治疗手段就是第三代EGFR-TKI,包括奥希替尼、艾维替尼等。
ALK
ALK是一种间变性淋巴瘤激酶。在ALK重排中,最常见的是棘皮动物微管相关蛋白样基因(EML4-ALK)。回顾性组织库研究显示,ALK基因重排非小细胞肺癌的发生约占非小细胞肺癌的3%-5%,不同种族的发生率无明显差异。ALK基因重排非小细胞肺癌患者往往是年轻人(确诊时大约50岁),和从不吸烟者(约70%-75%),或少量吸烟者。绝大多数表现为腺癌,且无性别倾向。与有EGFR突变的患者相比,ALK阳性患者确诊时中位年龄较为年轻(分别为61和57岁),从未吸烟者或少量吸烟者所占比例较高(一生<100支香烟;48%对比67%)。
克唑替尼是ATP竞争性酪氨酸激酶抑制剂,可抑制ALK和MET酪氨酸激酶,还能够抑制ROS1和RON激酶的活性。克唑替尼与ORR和中位PFS改善相关。
先前用克唑替尼治疗的大多数患者受益来自第二代ALK抑制剂包括ceritinib,alectinib和brigatinib。
第三代ALK抑制剂lorlatinib针对大多数已知的ALK抗性突变都有效果,并且对已经接受过多达三种ALK抑制剂的患者仍然有效。
ROS1
ROS1编码的受体酪氨酸激酶的激酶蛋白域与CD74基因融合时会导致激酶持续激活。由于高度的同源性,用于治疗ALK阳性的药物包括crizotinib,ceritinib和lorlatinib在ROS1阳性肿瘤中也显示出显著活性。
免疫治疗
2015年,FDA批准了首个用于治疗晚期NSCLC的免疫检查点抑制剂——PD-1抗体Opdivo,成为NSCLC治疗领域的里程碑。利用宿主的免疫反应来治疗癌症并不是一个新概念。引入免疫检查点抑制剂单克隆抗体即靶向细胞毒性T淋巴细胞抗原-4(CTLA-4)和抗体对抗PD-1或PD-L1标志着肺癌治疗的新方向。当前已经获批或正在开发NSCLC的ICB包括抗PD-1抗体nivolumab,抗PD-L1抗体atezolizumab、durvalumab和avelumab。
免疫检查点抑制剂已经被批准作为治疗接受一线化疗后肿瘤继续恶化的晚期NSCLC患者的标准疗法之一。在一线疗法方面,pembrolizumab已经成为肿瘤中PD-L1表达量超过50%的晚期或转移NSCLC患者的新标准疗法。这些患者可能占NSCLC患者总数的30%。在这些患者中,与以铂为主的细胞毒性疗法相比,pembrolizumab组ORR,PFS和OS显著改善。
免疫检查点抑制剂较少的毒副作用以及与化疗相仿的生存结果支持它们作为一线疗法治疗那些表达PD-L1的晚期NSCLC患者,尤其是那些无法接受化疗的患者。
化疗可以与ICBs构成组合疗法协同治疗肿瘤。一方面,化疗可以杀伤肿瘤细胞,从而改善T细胞和肿瘤细胞之间的比例,而且化疗可能减少免疫抑制因子的释放或者促进新抗原的释放,从而推广抗癌T细胞的免疫反应。Pembrolizumab联合化疗药物与单一化疗相比显著提高了患者的ORR和PFS。
尽管免疫检查点抑制剂单一疗法对于那些高度表达PD-L1或者携带高度肿瘤突变负担的肿瘤是合适的疗法,但是对于突变负担较低或在肿瘤中T细胞较少的肿瘤来说我们需要新的策略。这些策略包括使用化疗药物、表观遗传调控药物或者溶瘤病毒来制造激发免疫反应的肿瘤细胞死亡。另外一种策略包括与抗血管增生药物构成组合疗法。因为VEGF可以通过募集免疫抑制细胞来帮助构建免疫抑制TME,如骨髓来源的抑制因子细胞和调节性T细胞。此外血管增生抑制剂可以增加免疫细胞浸润。
对于那些突变负担低,少量T细胞浸润并且PD-L1表达量很低的肿瘤(“冷肿瘤”)来说,免疫疗法的挑战不单是将更多的效应T细胞吸引到TME中,还需要将肿瘤抗原呈现给T细胞。改善这方面的方法包括使用CAR-T细胞疗法,这种方法需要找到对NSCLC有特异性的细胞表面抗原。
癌症免疫疗法在短期内的显著成功表明它们可能成为未来治愈许多恶性肿瘤包括非小细胞肺癌的基础方案。

图3 晚期或转移性NSCLC的当前和在研治疗选择
然而,挑战也依然存在,包括鉴定新的驱动基因以扩大受益人群,更好的理解靶向治疗的抵抗机制以及更好地预测免疫疗法反应的生物标志物等。
推进个性化医疗和试验设计
靶向疗法的快速发展,更多新一代药物的出现以及获得性耐药机制的探索,确立了在肿瘤发展的过程中重复基因组特征分析是设计个体化医疗的关键步骤,特别是对于EGFR突变的患者,最常见的耐药性原因是T790M突变,而osimertinib可以成功治疗。
传统上通过重复活检来检查基因组特征,这一方法可能并不总是可行的,伴随着并发症的风险。一项新兴的选择是使用液体活检检查血液中的循环肿瘤DNA(ctDNA)。在回顾性分析表明,使用液体活检来检测EGFR T790M突变可以帮助筛选适于接受osimertinib治疗的患者。ctDNA检测包括高TMB的检测在内的多个分子标记物正在开发,以支持肺癌的个性化治疗。
由于许多基因突变是罕见,而且在临床试验中接受检测的组合疗法数以百计,招募患者进行临床试验变得越来越困难。为此,新的临床试验流程被设计出来。这类新流程可以在同一个临床试验中检测多种不同靶向疗法的作用(伞式试验),或者检测同一种靶向疗法对多种不同癌症的作用(篮式试验)。
展望未来
NSCLC的治疗发生了巨大的变化。对肿瘤生物学的了解让靶向疗法成为可能,迎来了个体化医疗的时代。此外,免疫检查点抑制剂的引入延长了患者的生存期。靶向治疗的主要问题之一是无效的二次克隆的出现,有必要进一步了解肿瘤获得抗性机制,重点是主要肿瘤和次级肿瘤可能是开发更有效持久的靶向疗法的必要条件。
ctDNA用于追踪早期肺癌的进化动态应该被扩展到检测致癌基因和抗性基因突变,从而提供一种ctDNA指导的靶向疗法模式。系统的收集组织样本,不仅是在诊断时,而且是在癌症进化过程中连续的时间点和不同的转移部位,这将是进一步治疗的关键。
发现更准确的预测因子对免疫疗法是非常重要的。虽然PD-L1和TMB都可以用来选择患者,但是大多数患者不属于使用这两种生物标记物划分出的理想人群。将癌症基因组信息与TME的细胞构成对应起来将有助于理性设计组合疗法。
参考文献:
The biology and management of non-small cell lung cancer.Nature volume553, pages446–454.
2018开篇丨肿瘤免疫治疗最新进展












