作者:
天津医科大学代谢病医院 郑少雄
中国人民解放军301医院 谷伟军
内容提要:美国糖尿病学会(ADA)科学年会发布的Banting科学成就奖是授予那些在糖尿病的认知、治疗和预防领域做出长期贡献的杰出学者,是科学成就最高奖项之一。2017年Banting科学成就奖授予哥伦比亚大学内科外科医师学院糖尿病研究中心主任Domenico Accili教授,表彰他多年来在对糖尿病发病机制的认知方面所做出的杰出贡献。
Acilli教授发表230篇论文,他进一步阐明肝糖产生机制,胰岛素B细胞的去分化进行了大量深入的研究,无论动物实验,还是人器官供体的研究,他和他的研究团队证实了胰岛β细胞去分化而不是或不完全是β细胞凋亡或死亡。他们的研究证实,胰岛β细胞去分化不仅会翻转到祖细胞状态,还可以转化为其他的内分泌细胞如分泌高血糖素的α细胞。
Accili 在6月11日作了糖尿病的新生物学演说,讲演的主要内容简介如下。

1
四十年回顾
首先他回顾了1977-2017这40年糖尿病研究和治疗进展和曲折的历程。
降糖药物层出不穷,联合治疗广泛使用,但是对于糖尿病本身,这些治疗多陷于困境,因为这些治疗既不能逆转也不能改变糖尿病,其根本原因是这些治疗未能解决糖尿病的两个关键病因:胰岛素抵抗和B细胞功能衰竭。此外,近年对降血糖药物的心血管安全性的要求,成为某些降糖药物的软肋。但是现代生物学已经成为解密诸多疾病成因的强大工具,对于糖尿病病因的认识也不例外,对胰岛素抵抗和胰岛β细胞衰竭的认识已达关键时刻,可以说已具备设计新一类药物并且根除糖尿病病因的能力。
2
FoxO1与胰岛素和高血糖素
近年对胰岛素作用的认识,焦点已经从细胞膜作用转移到细胞核,并且寻找哪些依赖胰岛素的转录因子,其中最重要的发现就是一种穿梭在细胞膜和细胞和之间的转录因子FoxO(Forkhead box O)。胰岛β细胞的关键调控因子。
胰岛素与其膜受体结合,进入胞浆,继而通过胰岛素受体底物(IRS)结合,然后通过PI3K/AKT 通路,调控FoxO1中苏氨酸,丝氨酸的磷酸化进出细胞核,进而调控葡萄糖激酶和葡萄糖-6-磷酸酶影响糖代谢。胰岛素受体和FoxO1之间有平衡环攀(Homeostatic loop),胰岛素和FoxO之间有诸多相互关系。
因此,在不同环节抑制FoxO1就可能改变甚至恢复胰岛素敏感性(图1)。因此开发小分子选择性的FoxO抑制剂有可能成为糖尿病药物治疗新的领域。这些小分子抑制剂应该在降低葡萄糖-6-磷酸酶的同时,升高葡萄糖激酶。
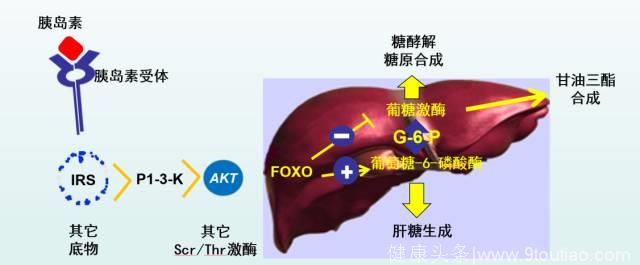
图1A 胰岛素对葡萄糖激酶和葡萄糖-6-磷酸酶的双向调节

图1B 胰岛素和FoxO 相互凉席对体内多功能的影响
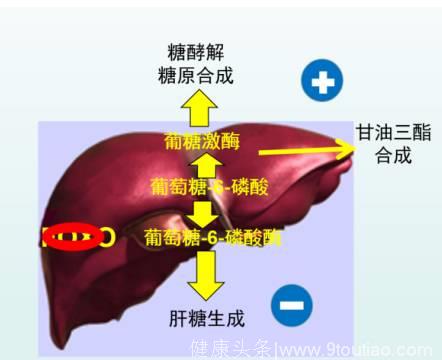
图1C 和FoxO1抑制后对的糖脂代谢平衡的影响
3
糖尿病的病因——胰岛β细胞是衰竭了吗
众所周知,胰岛素抵抗和胰岛β细胞衰竭是2型糖尿病的主要病因,特别是β细胞衰竭是糖尿病发生发展的主要原因。 但是在临床上经过强化生活方式或者强化药物治疗,糖尿病病情逆转或者临床缓解的病例。真正的胰岛β细胞功能衰竭了吗?Accili教授对此进行了大量深入的研究。首先他强调2型糖尿病的胰岛3项关键的异常:1)胰岛素对于刺激的反应受损;2)胰岛β细胞质量(mass)受损;3)不适当的胰高血糖素反应。
随着对FoxO1研究的深入,Accili等发现在糖尿病进展过程中,β细胞中FoxO活性增加,胰岛素显著减少,对其中的内在联系尚不明确,对于FoxO核转位是否与糖尿病发生有关,胰岛素的变化和FoxO的变化是同时发生还是其中一种变化导致另一种的变化,还没有明确的结论。Accili研究了糖尿病进展过程中不同阶段的β细胞基因网络活性(gene network activity)发现在代谢失灵阶段(inflexibility),FoxO1显著增加,而随着糖尿病的进展,在β细胞丢失、逐渐减少的过程中,原始细胞特征的细胞显著增加(图2),即β细胞的去分化现象(dediffeneration)。他们还发现β细胞去分化的同时,具有α细胞特征的细胞增加,β细胞向α细胞转化。这一重要发现是近年糖尿病β细胞研究的重大进展。所谓去分化就是在细胞形成过程中,并没有按照程序分化为具有激素分泌的功能β细胞,而是处于其原始细胞状态(progenitor cell),此类细胞并不具备分泌胰岛素的能力。
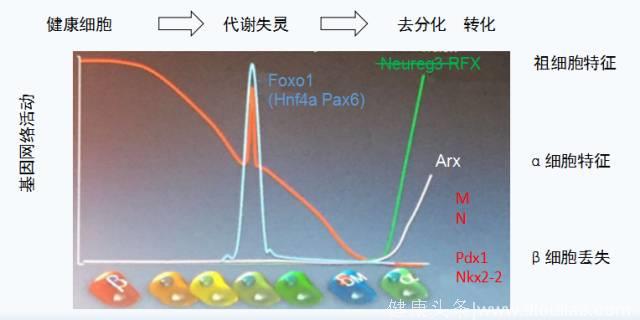
图2 胰岛β细胞衰竭进展的阶段:
在代谢失灵(inflexibility),FoxO1急剧增加,随着β细胞的逐渐丢失,祖细胞特征和ɑ特征样细胞逐渐增加,FoxO1具有促进代谢灵活性作用。
Accili教授认为,对去分化这一概念的认识并不是深奥生物学的发现,而是来自临床患者治疗的实践(部分病人强化治疗后的临床缓解或者逆转)。
Accili等通过遗传标记和免疫化学的方法进行细胞示踪试验,结果发现,糖尿病发生源自β-细胞去分化为原始细胞(progenitor cells)或转化为其他分泌激素的内分泌细胞如类ɑ-细胞。说明β-细胞并没有衰竭或者死亡(图3)。
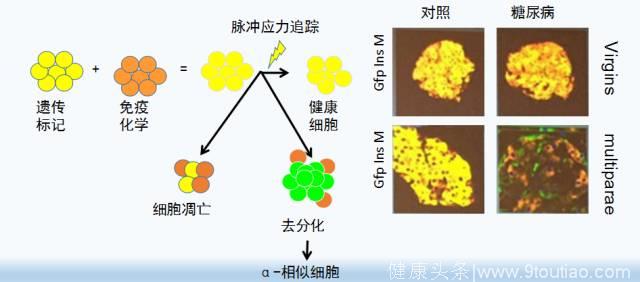
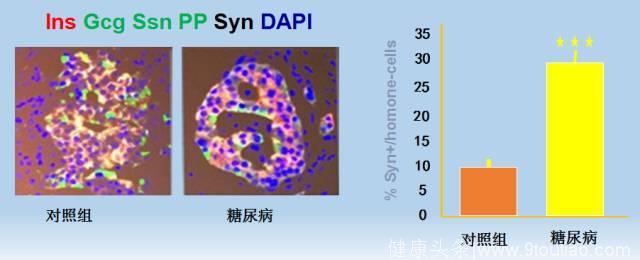
图3 细胞示踪结果证实糖尿病的发生是由β-细胞去分化所致,而非丢失(上)和人2型糖尿病患者胰岛β细胞去分化的证据(下)。
Accili等对人的2型糖尿病(器官提供者)胰岛β细胞的研究也明确证实了β细胞去分化和转化为其他内分泌细胞是2型糖尿病的重要特征。糖尿病供体胰岛素-阳性细胞下降32%(从77% 到53%)(P<1X10-6),Gcg-阳性细胞增加68%(从22%到37%)(P=0.009),使得α- to β-细胞比值从33%增加到63%。(P=0.0002)。(蓝色字体这一段引自Accili 2016年发表的文章)。胰岛β细胞去分化和转化这一重要发现为糖尿病早期强化治疗后的临床缓解或者逆转找到了实验室证据,为糖尿病的合理治疗奠定了基础。
4
新的增敏剂的合成
利用葡萄糖-6-磷酸酶和葡萄糖激酶之间的平衡,开发一类能够控制其基因调控的选择性小分子FoxO1抑制剂,可有助于开发新类型的胰岛素增敏剂。这种新一代增敏剂可以调控胰岛素信号转导的关键环节,选择性的抑制胰岛素抵抗,选择性的调控肝脏葡萄糖产生和脂类的生成将成为可能。(图4)

图4 选择性小分子FoxO 抑制剂--新一代增敏剂的研发
5
肠道内分泌细胞和1型糖尿病的治疗前景
Neurog-3-FoxO 基因敲除(NKO)小鼠的肠道发现了含有胰岛素的细胞。人体肠道有肠道内分泌(enteroendocrine )细胞。这些肠道内分泌细胞具有潜在胰岛素分泌的功能,为糖尿病的治疗展示了新的途径。
特别值得关注的是,肠道享有免疫特权,得自肠道的β-细胞可能会逃逸免疫监视,而且肠道内分泌祖细胞可由干细胞稳定的产生,因此其来源不受限制,为开发肠道内分泌细胞-分泌胰岛素的β-细胞创造了条件。
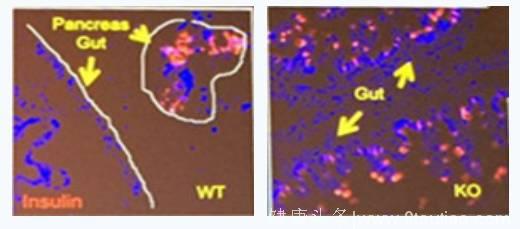

图5 A、B Neurog-3-FoxO 基因敲除(NKO)小鼠

图5C 人的肠道发现分泌胰岛素的肠道内分泌细胞
Accili 教授在讲演最后发问,2021年我如何治疗糖尿病,他选择了三点:
1.选择性胰岛素增敏剂;2.预防β-细胞去分化;3.以肠道为靶的FoxO 抑制剂治愈1型糖尿病。
Accili的研究成果从理论上证实了糖尿病初期经过强化生活方式或者药物治疗获得临床缓解或者糖尿病逆转这一临床现象的生物学基础,为糖尿病的治疗开辟了新的途径,大大改变了学界对糖尿病发病机制的认识。他对肠道内分泌细胞的研究证明,肠道内分泌细胞可以逃逸免疫监视,具有产生胰岛素的能力,为1型糖尿病的治疗提供了可能。
(制图 史作鹏)

如果您在糖尿病患者教育方面有经验、窍门、独特的模式等愿意分享,欢迎联系[email protected]