病例简介
一名67岁的前吸烟者出现肉眼血尿。最初检查显示肾功能正常,缺铁性贫血和碱性磷酸酶水平升高。 CT尿路造影显示前壁膀胱肿瘤和多处腹膜后淋巴结肿大。骨扫描发现两处椎体转移灶(T10和L2)。接受经尿道膀胱切除术,病理报告显示肌肉浸润性尿路上皮癌。
患者接受了顺铂和吉西他滨治疗。在接受该方案的3个周期后,影像显示疾病稳定。然而,完成6个周期后,患者发展为轻度骨痛。随访CT和骨扫描显示腹膜后淋巴结的数量增加和大小增大,出现新的右肾上腺转移以及第10肋骨的新骨损伤。
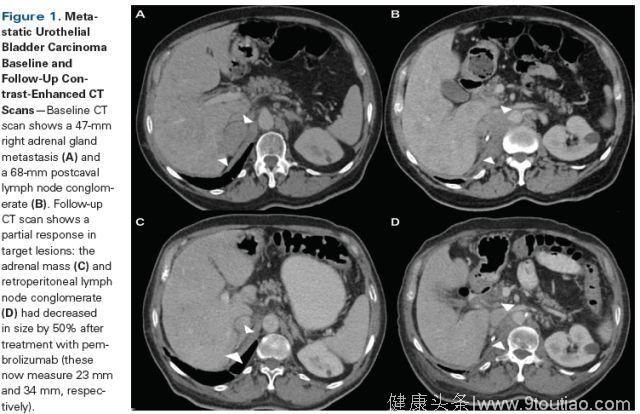
膀胱肿瘤组织免疫组织化学(IHC)显示肿瘤细胞和浸润免疫细胞中程序性死亡配体1(PD-L1)的表达> 10%。患者状态良好(Eastern Cooperative Oncology Group [ECOG]表现状态评分为1),因此该患者开始每3周使用pembrolizumab作为二线治疗。 3个周期后,患者发现有部分反应,随访CT扫描显示右肾上腺转移瘤和腹膜后淋巴结脓肿大小减少50%(图1)。此外,骨扫描显示骨损伤中放射性示踪剂摄取减少(图2)。患者将继续使用pembrolizumab治疗直至进一步评估。

问题
以下哪些生物标志物表明该患者在铂类治疗出现疾病进展后可以接受免疫治疗作为二线治疗?
A.通过IHC评估浸润免疫细胞的PD-L1表达> 5%
B.通过IHC评估肿瘤细胞和浸润免疫细胞的PD-L1表达> 5%
C.通过IHC评估肿瘤细胞和浸润免疫细胞的PD-L1表达> 10%
D.目前没有可靠的生物标志物
讨论
1.尿路上皮癌治疗的困境
膀胱癌是指发生在膀胱黏膜上的恶性肿瘤,是泌尿系统最常见的恶性肿瘤,占我国泌尿生殖系肿瘤发病率的第一位,其中膀胱癌患者总数的90%以上都是膀胱尿路上皮癌。
尿路上皮癌是泌尿生殖系统中第二常见的恶性肿瘤,也是美国第六大常见癌症。IV期转移性疾病与不良预后相关,5年时仅有5%的生存率。吉西他滨+顺铂方案为晚期膀胱尿路上皮癌首选的一线化疗方案之一,其有效率较高,不良反应患者可以耐受,预计生存9至15个月。
就像本例患者一样,大多数患者最终会在铂类化疗后出现疾病进展,并需要进一步治疗。然而,在这种情况下缺乏有效的二线治疗。
二线治疗中使用的单药化学疗法,如紫杉醇,多西他赛,吉西他滨和培美曲塞,仅在II期研究中进行了测试,已经证实了低有效率和高毒性。
Vinflunine是在安慰剂对照的随机III期临床试验中证明有益的唯一细胞毒性药物。尽管如此,该药的客观缓解率(ORR:8.6%)却令人失望,而且该药没有与其他常用的化疗药物比如紫杉烷进行比较,在美国从未获得批准。在最近的意向性治疗分析中,总体生存率(OS)差异(6.9 vs 4.6个月)未达到显著性差异。
2.免疫检查点抑制剂的出现
30年来,晚期尿路上皮癌的治疗尚无重大突破,特别是二线治疗仍处于探索阶段。
最近发现免疫检查点抑制剂在具有高PD-L1表达的肿瘤和具有高体细胞突变负荷的肿瘤中非常活跃。据癌症基因组图谱研究报道,膀胱癌突变率第三高,仅次于肺癌和黑色素瘤。
这一事实促进了铂治疗失败后应用免疫检查点抑制剂的研究,特别是针对PD-1或PD-L1的药物。这些研究的结果让美国食品和药物管理局(FDA)在1年的时间框架内批准了5种抗体,包括pembrolizumab,nivolumab,atezolizumab,durvalumab和avelumab。

我们决定为该患者开具pembrolizumab(KEYTRUDA,默沙东),因为在2017年5月18日,FDA批准Pembrolizumab用于局部晚期或转移的尿路上皮癌患者,这些患者在含铂化疗期间或之后出现疾病进展或采用含铂方案作为新辅助或辅助治疗12个月内出现进展。
该批准所基于的研究-KEYNOTE-045-是一项III期多中心开放标签随机试验,该研究纳入了542名局部晚期或转移性尿路上皮癌患者,这些患者对顺铂化疗不耐受。患者每3周注射一次pembrolizumab200mg,中位随访时间为7.8个月。
Pembrolizumab组的中位OS为10.3个月,化疗组为7.4个月,死亡危险比为0.73(95%CI,0.59-0.91; P = .002)。与化疗组相比,Pembrolizumab组的ORR较高(21.1%对11.0%),中位缓解持续时间更长。不论是在总体患者人群还是CPS≥10%患者中,PFS没有显着的组间差异。
安全性方面,PD-1抑制剂组与化疗组相比,治疗相关不良事件的发生率低于化疗组(60.9%vs 90.2%),化疗组患者发生3,4,5级事件的发生率更高(分别为15%和49.4% %)。良好的耐受性对于尿路上皮癌患者尤为重要,因为这些患者中有许多患者有合并症状和/或老年人,他们通常被认为不适合接受化疗或不愿意接受治疗。
3.PD-L1的表达就是疗效预测指标吗?
检查点抑制剂试验不依赖于患者的PD-L1状态,而是依赖于患者的表现状态和疾病负担。在pembrolizumab试验中,如果患者的ECOG表现状态评分为0,1或2,则患者有资格进行研究。如果患者有一个或多个确定的Bellmunt预后不良因素(血红蛋白浓度<10 g / dL,肝转移的存在或入组前最后一次接受最近一次化疗的剂量<3个月),那么患者不适合。
在所有免疫检查点抑制剂试验中,根据PD-L1状态研究总体人群的ORR。然而,用于评估PD-L1状态的方法,所使用的IHC测定以及临界值在各项研究中差异很大,导致PD-L1阳性的定义在各项试验中非常不一致。用于定义PD-L1状态的指标和程序的标准化是未满足的需求。
PD-1/PD-L1检测点调节肿瘤微环境内的局部免疫应答,因此,在肿瘤细胞和浸润性免疫细胞上的PD-L1表达成为使用PD-1/PD-L1检测点抑制剂的有力预测生物标志物。在PD-L1表达高于50%的患者使用PD-1抑制剂也只有不到50%的有效率,而在小部分患者PD-L1表达阴性,却也能从免疫检查点抑制剂的治疗中收益,但这种比例低于10%。这是由于肿瘤的免疫结构具有非常大的异质性和动态变化导致的,因此,确定有效的免疫治疗生物标志物非常具有挑战性。尽管有着较多的不确定性及免疫复杂性,临床试验的结果确实支持对于免疫组化高表达PD-L1的患者可以从PD-1/PD-L1抑制剂中获得更好疗效。
发现具有预测肿瘤治疗反应的生物标志物是非常有意义的,它有助于优化临床实践中的决策。然而,由于肿瘤细胞和免疫细胞上的PD-L1表达是一个动态过程,所以在单个时间点由IHC测量的PD-L1状态评估不足以预测对免疫疗法治疗的反应。另外,伴随治疗(化疗,放疗或抗血管生成药物)等外部因素可诱导PD-L1表达,进一步影响对免疫治疗药物的反应。
总之,目前缺乏PD-1/PD-L1抑制剂治疗晚期尿路上皮癌的预测性生物标记物。无论患者的PD-L1状态如何,应根据患者的表现状态和预后风险因素,决定是否接受免疫药物治疗。
正确答案:D
文章编译自:Is This Patient With Metastatic Bladder Cancer a Candidate for Second-Line Immunotherapy Treatment?cancernetwork.com.
1.软组织肉瘤内科治疗,现状与未来
2.科研人员请注意:免疫检查点抑制剂临床终点推荐选择6个月PFS
3.麻省总院大咖带您现场感受美式诊疗 嘉会医疗-麻省总医院乳腺癌国际研讨会即将召开