2018年元旦期间,我们推送了一篇劝大家戒酒的文章。这篇文章在酒圈引起轩然大波,阅读量很快就突破50万。
来自剑桥的研究团队发现,由于人体酒精代谢相关基因的存在基因型多样性,那些乙醛脱氢酶基因有缺陷的人,酒精代谢产生的乙醛不能降解,会提高多种癌症风险。
这就是同样是喝酒,不同的人却有不同反应的原因。
其实用药也存在这个问题。
中国人基因多态性可致支架内血栓风险增加近5倍去年年底发布的《中国心血管病报告2017》[3]显示,我国心脑血管疾病患者人数已经高达2.9亿,每年因心脑血管疾病离开这个世界达400万人左右,其中近乎一半左右的死亡,源于急性冠状动脉综合征(ACS,包含心梗及不稳定心绞痛)。
国内治疗ACS的标准疗法是二磷酸腺苷(ADP)受体抑制剂联合阿司匹林的双抗疗法,其中氯吡格雷+阿司匹林在我国广泛使用。
实际上在氯吡格雷投入临床使用没多久之后,医生就发现很多患者出现氯吡格雷抵抗,就是这个药对患者无效。实际上,作为前体药物,氯吡格雷本身是不起作用的,它需要体内关键的酶处理之后才能发挥作用。
对于氯吡格雷来说,这个关键的基因是CYP2C19基因。如果这个基因功能缺失,ACS患者就不能有效代谢氯吡格雷,那么就可能出现氯吡格雷抵抗现象。而这对于ACS患者而言,是非常危险的。
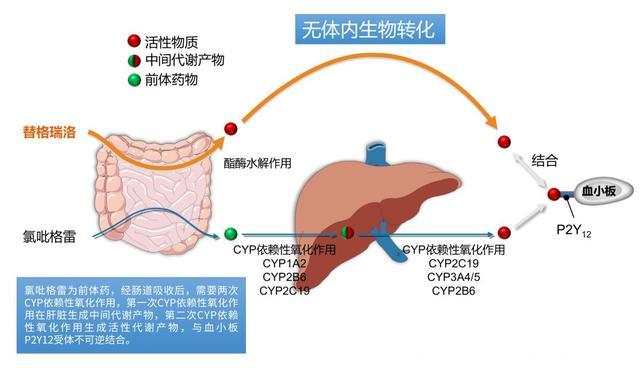
对于这种现象,FDA已经在氯吡格雷说明书中给予黑框警告:警示氯吡格雷的疗效取决于其活性代谢物的活性,对于CYP2C19弱代谢者,考虑其他CYP2C19抑制剂治疗[4]。
遗憾的是,目前已经有大量的研究表明,CYP2C19基因功能缺失突变在西方国家患者中的携带率为30%,而亚洲患者的携带率在50%-60%之间[5-8]。


虽是漫画,但不是笑话,类似的情况可能正发生你的亲朋好友身上
去年8月份,在全球最大规模的心血管领域盛会——欧洲心脏病学会(ESC)2017年会上,来自首都医科大学附属北京安贞医院的刘巍教授团队,在会议上报告了一项氯吡格雷使用的meta分析研究成果[9]。他们分析了20项研究共计15056例亚洲冠心病患者,发现在这个群体中,CYP2C19基因功能缺失携带者占到56.98%。
CYP2C19基因功能缺失携带者的主要心血管不良事件风险是非携带者的1.74倍(10.58% vs. 6.07%),其中支架内血栓形成风险是非携带者的5倍(2.22% vs. 0.44%)。单独分析使用更高负荷剂量的氯吡格雷,上述相关性仍旧存在。
刘巍教授的这个研究表明,CYP2C19基因功能缺失会降低亚洲冠心病患者对氯吡格雷的敏感性,导致不良事件风险上升,而且提高氯吡格雷剂量也无法给患者带来明显获益。
不仅挑人,还不能降低患者死亡率2014年,刊登在《新英格兰医学期刊》上的DAPT临床研究显示,氯吡格雷可能会增加患者死亡风险和癌症相关死亡风险[10]。这引起了FDA的高度重视。随即FDA研究了DAPT和其他大型、长期治疗临床试验数据,发现使用氯吡格雷不会增加患者患癌症,以及因癌症死亡的风险。
但,让FDA感到意外的是,他们还同时发现,氯吡格雷和阿司匹林长期(12个月或更长)联合治疗,与短期(6个月或更短)联合治疗或阿司匹林单独治疗相比,并没有降低急性冠状动脉综合征(ACS)患者总体死亡风险[11]。

FDA调查结果[11]
次年,FDA修改了氯吡格雷的说明书[4]。
将“在NSTE-ACS患者中,氯吡格雷显示能降低心血管死亡、心梗或卒中的复合终点事件率,同时能降低心血管死亡、心梗、卒中或再发缺血的复合终点事件率”,改为“氯吡格雷显示能降低心梗和卒中的发生率”。
“氯吡格雷显示能降低心血管死亡”被删除。
同时将“在接受药物治疗的STEMI患者中,氯吡格雷显示能降低全因死亡率以及死亡、再梗或卒中复合终点事件率。氯吡格雷在接受直接PCI的STEMI患者中的获益尚未明确”,改为“氯吡格雷适用于接受药物管理的STEMI患者,可降低心梗和卒中的发生率”。
“氯吡格雷显示能降低全因死亡率”被删除。
简单的说就是,氯吡格雷不能降低ACS患者的心血管死亡,也不能降低ACS患者的全因死亡率,至少目前看来是这样。

被删改的说明书[4]
降低死亡率这个事情的重要性该如何理解呢?
举个例子。假如有一位晚期癌症患者,医生告诉患者家属,有两个治疗方法可选,第一个方法是传统方法,可以缓解患者的症状,但是患者一年内死亡的风险是100%;第二个方法不仅可以缓解患者的症状,而且患者一年内死亡的风险是80%。
就是这样高下立判。
患者需要缓解症状,但是患者更需要的是活下去的希望。不能降低患者死亡风险的疗法,就是把患者置于风险之中。
除却生死无大事,能降低死亡率才是王道对于数量众多的ACS患者而言,他们期待的应该是长期的安全保护。
那现阶段究竟有没有什么办法可以长时间(一年及以上)降低患者的心血管死亡,甚至是全因死亡风险呢?
2009年涉及18624例ACS患者,平均随访时间长达12个月的大型临床研究PLATO试验结果发布。PLATO研究,是国际多中心、双盲、双模拟、随机对照研究,入组患者在服用阿司匹林基础上,随机给予替格瑞洛180mg负荷剂量,90mg维持剂量每天两次服用,或氯吡格雷300-600mg负荷剂量,75mg维持剂量每天一次服用。
结果显示,与氯吡格雷联合阿司匹林(5.1%)相比,替格瑞洛联合阿司匹林(4.0%)显著降低ACS患者一年心血管死亡死亡相对风险达21%[12]。同时,氯吡格雷联合阿司匹林组的全因死亡率是5.9%,而替格瑞洛联合阿司匹林组的全因死亡率是4.5%,相对风险也下降了22%。
这意味着,在阿司匹林的基础上,替格瑞洛每年可多挽救3万多中国ACS患者。而这一点,从氯吡格雷的说明书来看,它是做不到的。
替格瑞洛是继阿司匹林后,唯一在大型临床试验中被证实可在阿司匹林基础上进一步降低ACS患者1年心血管死亡风险的口服抗血小板药物。
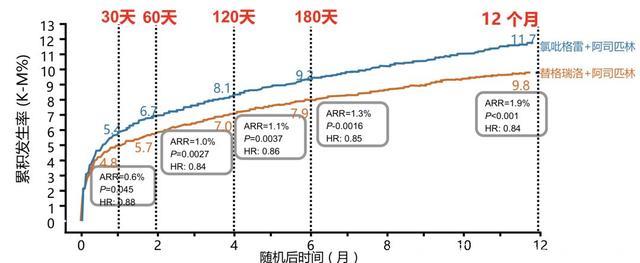
主要终点事件的累计发生率比较[12]
此外,PLATO研究证实替格瑞洛获益30天显现,且持续增加达12个月,30天时曲线即分离(相对风险降低(RRR) 12%),且在12个月治疗期间曲线继续分离(RRR 16%) 。与氯吡格雷相比,总体主要出血发生率无显著性差异。
在2015和2017年先后发表在《新英格兰医学期刊》和《美国心脏病学会杂志》上的PEGASUS-TIMI 54临床研究及其亚组分别发现,替格瑞洛60mg联合阿司匹林较阿司匹林单药进一步降低高危心梗后患者3年心血管事件(心血管死亡、心肌梗死、卒中)相对风险16%[13];持续使用替格瑞洛获益一致,且在心梗发病2年内的患者,替格瑞洛60mg进一步降低心血管死亡风险32%[14]。
另一件重要的事情是,替格瑞洛不是前体药物,服下去就可以直接起作用,因此不存在氯吡格雷那样的人群基因差异选择。这就给患者提供了多一层的生命安全保护。
正是基于替格瑞洛的临床效果,2016年,由中国医师协会心血管内科医师分会血栓防治专业委员会发起的《替格瑞洛临床应用中国专家共识》对替格瑞洛在ACS患者中的使用给出了首选推荐[15]。
此外,2017年的《ESC ST段抬高型心肌梗死管理指南》和《ESC冠心病双联抗血小板治疗指南》,以及2016年的《中国经皮冠状动脉介入治疗指南》均对替格瑞洛在ACS患者中的使用给出了首选推荐。
替格瑞洛为ACS患者提供了不错的选择,但是临床使用中,仍要积极评估患者的获益与风险。不过无论如何,患者的生命安全永远是排在第一位的。
参考资料:
[1]. Garaycoechea J I, Crossan G P, Langevin F, et al. Alcohol and endogenous aldehydes damage chromosomes and mutate stem cells[J]. Nature, 2018.
[2]. Lai C, Yao C, Chau G, et al. Dominance of the Inactive Asian Variant Over Activity and Protein Contents of Mitochondrial Aldehyde Dehydrogenase 2 in Human Liver[J]. Alcoholism: Clinical and Experimental Research, 2014, 38(1): 44-50.
[3]. 陈伟伟,高润霖,刘力生,朱曼璐,王文,王拥军,吴兆苏,李惠君,顾东风,杨跃进,郑哲,蒋立新,胡盛寿.《中国心血管病报告2017》概要[J].中国循环杂志,2018(01):1-8.
[4]. https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2016/020839Orig1s062,s064ltr.pdf
[5]. Man M, Farmen M, Dumaual C, et al. Genetic variation in metabolizing enzyme and transporter genes: comprehensive assessment in 3 major East Asian subpopulations with comparison to Caucasians and Africans[J]. The Journal of Clinical Pharmacology, 2010, 50(8): 929-940.
[6]. Desta Z, Zhao X, Shin J G, et al. Clinical significance of the cytochrome P450 2C19 genetic polymorphism[J]. Clinical pharmacokinetics, 2002, 41(12): 913-958.
[7]. Lee J M, Park S, Shin D J, et al. Relation of genetic polymorphisms in the cytochrome P450 gene with clopidogrel resistance after drug-eluting stent implantation in Koreans[J]. American Journal of Cardiology, 2009, 104(1): 46-51.
[8]. Hwang S J, Jeong Y H, Kim I S, et al. The cytochrome 2C19* 2 and* 3 alleles attenuate response to clopidogrel similarly in East Asian patients undergoing elective percutaneous coronary intervention[J]. Thrombosis research, 2011, 127(1): 23-28.
[9]. Xi Z, Fang F, Wang J, et al. CYP2C19 genotype and adverse cardiovascular outcomes after stent implantation in clopidogrel-treated Asian populations: A systematic review and meta-analysis[J]. Platelets, 2017: 1-12.
[10]. Mauri L, Kereiakes D J, Yeh R W, et al. Twelve or 30 Months of Dual Antiplatelet Therapy after Drug-Eluting Stents[J]. The New England Journal of Medicine, 2014, 371(23): 2155-2166.
[11]. https://www.fda.gov/downloads/Drugs/DrugSafety/UCM471586.pdf
[12]. Wallentin L, Becker R C, Budaj A, et al. Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes[J]. The New England Journal of Medicine, 2009, 361(11): 1045-1057.
[13]. Bonaca M P, Bhatt D L, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction[J]. New England Journal of Medicine, 2015, 372(19): 1791-1800.
[14]. Bonaca M P, Storey R F, Theroux P, et al. Efficacy and safety of ticagrelor over time in patients with prior MI in PEGASUS-TIMI 54[J]. Journal of the American College of Cardiology, 2017, 70(11): 1368-1375.
[15]. 韩雅玲. 替格瑞洛临床应用中国专家共识[J]., 2016.