近期糖尿病领域爆出了大新闻:格华止XR(缓释片)在我国隆重上市。吃瓜群众纷纷好奇,这到底是个什么药?它与其他同类药有啥不同?
来源丨医学界内分泌频道
为了解答广大糖尿病医生和患者对新药的疑惑,《医学界》专访沈阳药科大学的药剂专家付强副教授,请他从药剂学的角度为大家讲解新药背后的“玄机”。

付强副教授接受《医学界》采访
1
缺陷诱发需求:二甲双胍普通片存在的问题
二甲双胍是我国糖尿病诊治指南推荐中的基石性用药[1],但其在应用过程中却存在以下问题:
1
部分患者有胃肠道不良反应
二甲双胍是水溶解性很高的药物,故服用后其在胃肠道内迅速释放,局部药物浓度较高,对局部胃肠道黏膜产生直接刺激。
2
每日服用次数多影响依从性
这一方面是由于其胃肠道刺激大导致的,另一方面是由于二甲双胍半衰期较短,为了维持其血药浓度,需每日服药2-3次。记忆力下降的老年患者或工作繁忙的患者,很容易出现漏服现象。
对于糖尿病患者而言,迫切希望在保证药效的同时,减少服药次数和胃肠道不良反应,这就使得二甲双胍缓释制剂的研发势在必行。
2
囚笼困兽:二甲双胍缓释制剂陷研发绝境
各种口服制剂在药剂开发时关注的重点是其吸收性,而药物的吸收主要受两大因素的影响[2, 3]:一是药物的溶解性,即水溶性;二是肠道通透性,包括被动扩散、主动运输等。
1
难点之一:高水溶性
二甲双胍是高溶解性药物,这类药物的缓释制剂需要加入大量辅料来控制药物释放速度;另外,二甲双胍最小推荐剂量为500 mg/日,而其最佳有效剂量为2000 mg/日[4]。制作时添加的辅料量就更大,这就导致药品体积过大,不易吞咽。并且,辅料的水合速度较慢,可能发生不利的“最初迅速释放”[5]。
2
难点之二:吸收窗窄
二甲双胍的吸收方式是主动运输,其转运蛋白主要分布于十二指肠和空肠上段[6]。通常,药物在十二指肠的滞留时间为0.26 h,即15 min;在空肠上段的滞留时间为0.95 h即57 min。这短短的1个多小时,恐怕能吸收的药量极其有限。
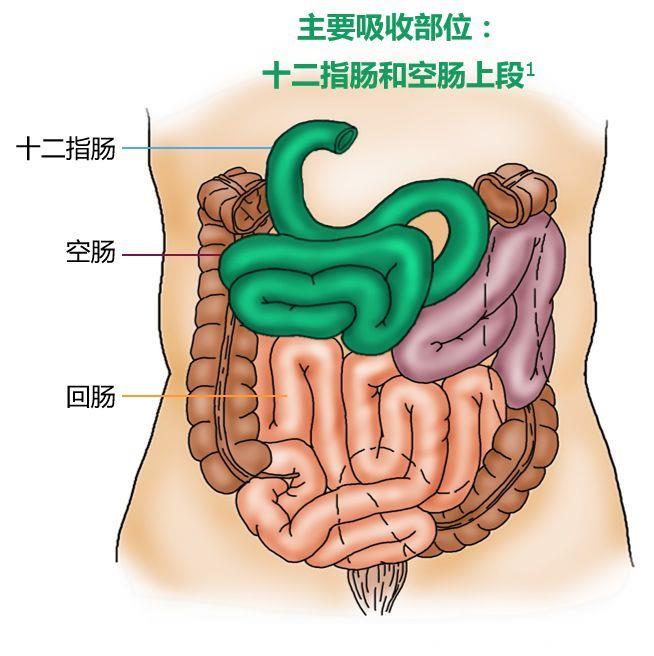
图:二甲双胍的主要吸收部位
3
独门绝技显神威:格华止XR的“创新”突破
那么如何解决这两大问题呢?研究者逆向思考,试图靠延长药物在胃内的滞留时间达到缓慢释放,同时延长吸收时间。在经过长时间的探索之后,开发者另辟蹊径,创新性地开发了一项“独门秘笈”——GSD双相控制系统,格华止XR应运而生。

图:GSD双相控制系统同时获得了美国、欧洲和中国的专利,目前还在专利期内
所谓“双相”,即外层为羟丙基甲基纤维素等构成的连续固相,内层为二甲双胍及疏水性材料构成的连续粒子相[7],两相在二甲双胍缓释过程中均起到重要作用。
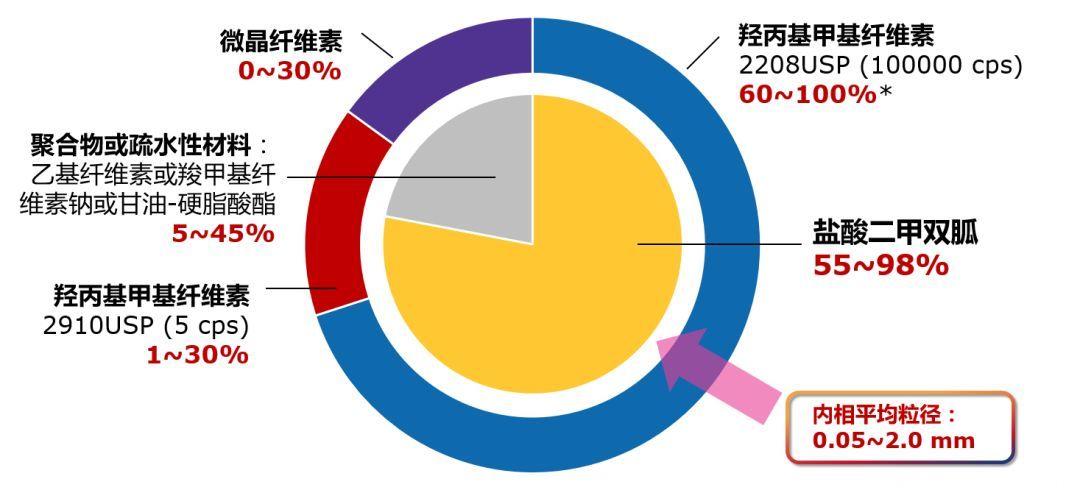
图:格华止XR药物内结构示意图
服药后,外层在胃中遇水膨大3倍左右,使其体积>15mm(这是幽门口的大小),不易通过幽门,有效地提高了药物在胃内的滞留时间。内层的二甲双胍被逐步释放出,随胃蠕动进入十二指肠,其与十二指肠和空肠上段的接触时间增加。
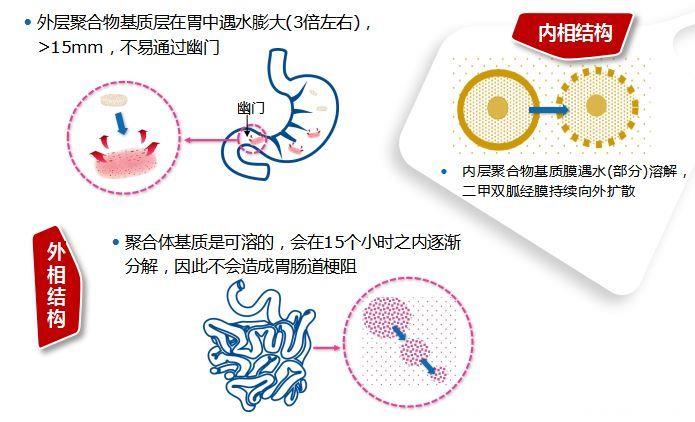
图:格华止XR的核心工艺示意图
可能有心人会产生疑问,膨大到这么大体积会导致肠道梗阻吗?付强副教授解释道,这点大可放心,因为外层的聚合体基质是可溶的,会逐渐溶蚀,因此不会造成胃肠道梗阻。
4
与其他剂型比较:缓释片出,谁与争锋?
在了解完新药的“神奇”工艺之后,对于临床医生和糖尿病患者而言,又一个重要的问题随之而至:除了服药次数改为了1天1次,格华止XR与目前常用的格华止普通片和二甲双胍肠溶片在药代动力学参数上有何区别?
1
VS格华止普通片:达峰延迟,药效不变
据Timmins P教授等发表于Clin Pharmacokinet的研究[8]显示:与格华止普通片相比,格华止XR使得二甲双胍的达峰时间从给药后3小时推迟至7小时。
格华止XR 2000 mg一天一次给药与普通片 1000 mg一天两次给药的血药浓度-时间曲线下面积(AUC)相似,表明格华止XR与格华止普通片的吸收程度相当。
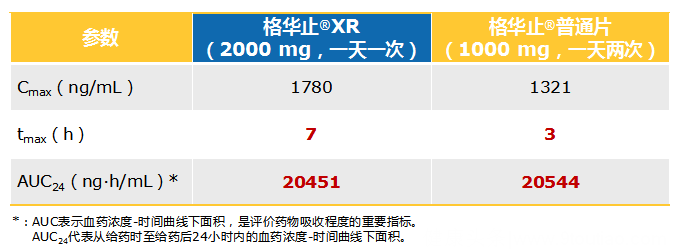
图:格华止XR与格华止普通片药代动力学参数比较
2
VS二甲双胍肠溶片:肠溶剂型生物利用度更低
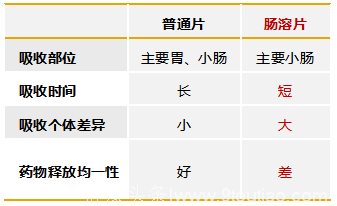
目前市场上还有一种二甲双胍肠溶制剂,即利用人体的pH梯度差异,在二甲双胍药物外层包裹肠溶材料,在中性和弱碱性环境下(进入肠道中)才开始溶解。
但是肠溶剂型的一大问题在于,二甲双胍同时在小肠内崩解和吸收,但因为在小肠中停留时间短,导致进入药物吸收较差区域仍有大量药物未释放,二甲双胍有效吸收大大降低。
表:二甲双胍普通片Vs肠溶片
何林[9]等以原研药盐酸二甲双胍(格华止)为参比制剂,对已上市的盐酸二甲双胍肠溶片的人体生物等效性进行再评价,发现格华止的AUC为6.18 μg•h/mL,而肠溶片A和肠溶片B的AUC分别为4.52μg•h/mL和2.85μg•h/mL,可见两种肠溶片的生物利用度均低于格华止。而格华止XR的药物吸收程度与格华止普通片相当,因此它的生物学利用度要明显优于二甲双胍肠溶制剂。
5
地位彰显:格华止XR是唯一缓释片参比剂
说了这么多,格华止XR在市场上的二甲双胍缓释片类药物中到底是何等地位呢?
2016年5月,国务院发布《开展仿制药质量和疗效一致性评价的意见》公告,自此,一致性评价大幕逐渐拉开。国家公布盐酸二甲双胍缓释片仿制药参比制剂目录,将格华止XR定为唯一缓释片参比剂[10]。
什么是参比剂?就是我们参加考试时的那个标准答案,相当于“金标准”。仿制药要以格华止XR为标准,进行体外药学部分以及体内的生物等效性评价。
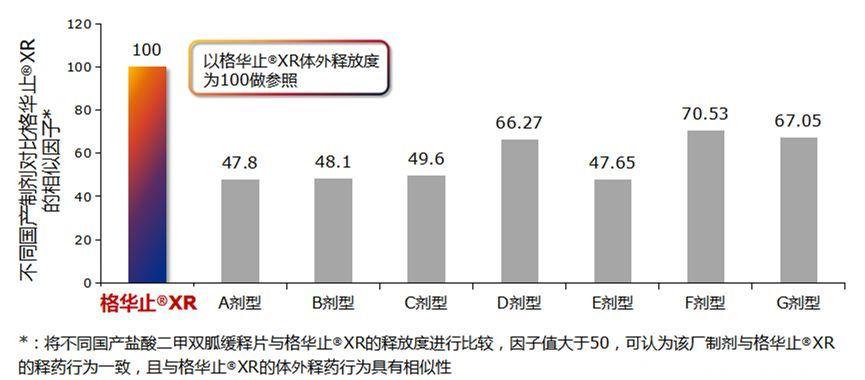
图:以格华止XR体外释放度为100做参照,部分国产缓释剂型(A剂型、B剂型、C剂型、E剂型)与格华止XR的体外相似因子稍低[11]
付强副教授在采访最后总结道:“设计药物剂型需考虑药物理化性质、胃肠吸收、药理学和药效学性质等因素。格华止XR专利基于二甲双胍代谢特点设计,能够延长药物释放,增加药物吸收、提高胃肠耐受性以及病人依从性。它的优秀品质和专利技术成为中国仿制药一致性评价中参比制剂,我们期待它在临床上得到广泛使用,造福更多的糖尿病患者。”
专家简介
付强,博士,副教授,硕士生导师。2007年获沈阳药科大学药剂学学士学位;2012获沈阳药科大学药剂学博士学位;后于美国北卡大学教堂山分校分子药剂系进行博士后研究;现于沈阳药科大学药剂教研室任教,主要研究方向为药物制剂新技术提高难溶性药物口服吸收。荣获“辽宁省百千万人才工程万人层次”,作为项目负责人先后承担多项科研课题研究,包括国家自然基金1项、辽宁省自然基金1项、省厅级基金2项目、校基金2项。SCI收录论文18篇。现为Asian Journal of Pharmaceutical Sciences杂志助理编辑,International Journal of Pharmaceutics, International Journal of Nanomedicine, Current Drug Delivery等杂志审稿人。
参考文献:
1.中国2型糖尿病防治指南(2013年版). 中国糖尿病杂志. 2014; (08): 2-42.
2.Amidon GL, et al. Pharm Res. 1995 Mar;12(3):413-20.
3.Cheng CL, et al. Eur J Pharm Sci. 2004 Jul;22(4):297-304.
4.二甲双胍临床应用专家共识(2016年版). 中国糖尿病杂志. 2016; 24(10): 871-83.
5.Ghori MU, et al. Am J Pharmacol Sci. 2015; 3(5): 103-9.
6.Diabetes, 2016, 65:1724-1730.
7.发明专利申请公开说明书:《高溶解性药物的双相控释递送系统和方法》中国, CN99804134 .3[P]. 2001-5-16.
8.Timmins P, et al. Clin Pharmacokinet. 2005;44(7):721-9.
9.何林, 等. 华西药学杂志. 2004; 19(3): 179-81.
10.仿制剂第五、六批参比剂目录,http://www.sda.gov.cn
11.吴燕, 等. 安徽医药. 2014; 18(6): 1050-2.